El cáncer de pulmón (CP) es una de las enfermedades oncológicas más prevalentes a nivel global, ocupando el segundo lugar en cuanto a nuevos diagnósticos, detrás del cáncer de mama, y siendo la principal causa de mortalidad relacionada con el cáncer (1). En Argentina, la situación se asemeja a la tendencia mundial, ya que es el tercer tipo de cáncer más incidente en la población y ocupa el primer lugar en cuanto a muertes relacionadas con el cáncer en varones (2, 3).
Las tasas de supervivencia de los pacientes con CP es altamente variable y depende de diversos factores como la etapa de la enfermedad en el momento del diagnóstico, la edad y el estado de salud general del paciente, y la eficacia del plan de tratamiento seleccionado. En los EE. UU., la supervivencia a 5 años es del 59,0 % para aquellos con enfermedad localizada en el momento del diagnóstico (estadio I-II), disminuyendo al 31,7 % entre aquellos con enfermedad regional (estadio III) y al 5,8 % entre aquellos con enfermedad metastásica (estadio IV). Desafortunadamente, la mayoría de los casos (>60%) se diagnostican en una etapa avanzada de la enfermedad, lo que se traduce en un pronóstico menos favorable (4).
Este tipo de cáncer se divide principalmente en dos categorías según las células de origen: el CP de células no pequeñas (CPCNP) y el CP de células pequeñas (CPCP). El CPCNP constituye más del 87% de los casos, siendo los subtipos principales el adenocarcinoma (50-60%), carcinoma de células escamosas (20-30%) y carcinoma de células grandes.
Las opciones de tratamiento para el CPCNP se basan en factores como el grado, el tamaño y la ubicación del tumor, el estado de los ganglios linfáticos, la salud general del paciente y la función pulmonar. Las modalidades de tratamiento aprobadas incluyen cirugía, quimioterapia, radioterapia, inmunoterapia y terapia dirigida, entre otras, y la elección depende de los factores mencionados anteriormente (5).
Se ha observado una diversidad de alteraciones genéticas drivers en el CPCNP, que incluyen variantes puntuales (SNVs), pequeñas inserciones y/o deleciones (indels) y fusiones génicas en diferentes genes (Figura 1) (6).
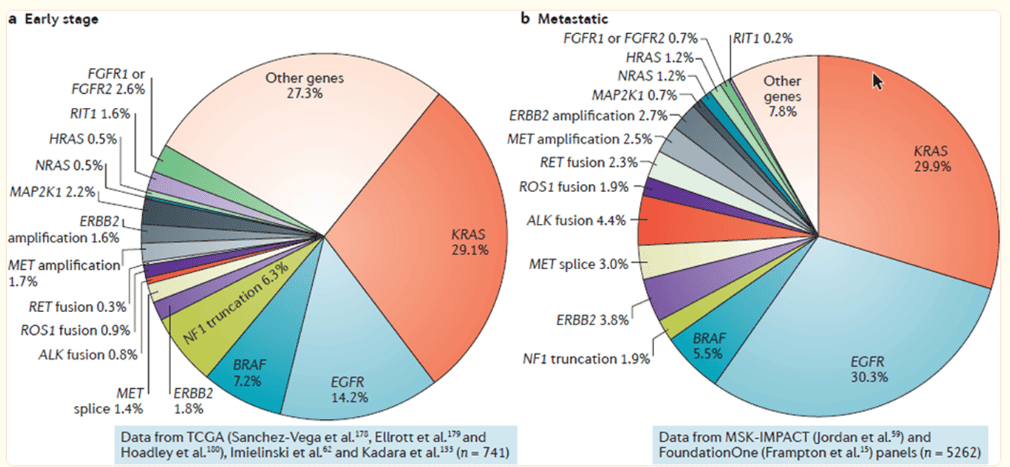 Figura 1. Diversidad y prevalencia de alteraciones genéticas drivers en CPCNP en estadio temprano y avanzado. Tomado de Skoulidis F. et al., 2019.
Figura 1. Diversidad y prevalencia de alteraciones genéticas drivers en CPCNP en estadio temprano y avanzado. Tomado de Skoulidis F. et al., 2019.
Esta diversidad de alteraciones genéticas ha llevado al desarrollo y aprobación de terapias dirigidas para muchas de ellas en los últimos años (Figura 2), lo que ha mejorado significativamente la supervivencia global de pacientes con enfermedad avanzada (7).
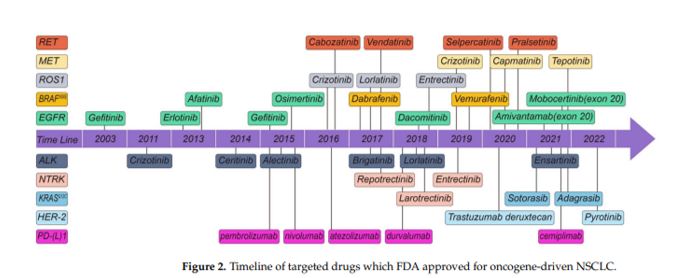
Figura 2. Diferentes terapias dirigidas a alteraciones genéticas especificas aprobadas por la FDA a lo largo de los últimos 20 años. Tomado de Guo H. et al., 2022.
Este conjunto de factores ha llevado a que diversas guías internacionales recomienden la realización de pruebas de múltiples genes en pacientes con CPCNP avanzado y/o metastásico para identificar adecuadamente a aquellos que pueden beneficiarse de estas terapias (8,9).
Estos estudios a menudo se realizan de manera secuencial, testeando biomarcadores individuales mediante diversas técnicas como qPCR, FISH e IHQ, lo que puede llevar mucho tiempo en obtener resultados e incluso agotar la muestra antes de llegar a un diagnóstico, por lo que no resulta una opción costo-efectiva (10).
Por otro lado, hoy en día existen diversos paneles multigenéticos que se pueden realizar mediante secuenciación NGS, lo que permite evaluar varios genes relacionados con el cáncer en una misma muestra. Sin embargo, estos paneles suelen tener tiempos de entrega de resultados largos, requieren un costoso equipamiento de laboratorio y personal altamente entrenado, además de que la calidad de la muestra puede ser insuficiente para ejecutar el ensayo o arribar a resultados debido a los requerimientos de esta tecnología (11).
Una nueva e innovadora alternativa es el uso de paneles multigenéticos por PCR en tiempo real, que ofrecen una estrategia sensible, de rápida obtención de resultados, con mínimos requerimientos de muestra y equipamiento de laboratorio, y con resultados de fácil interpretación.
En Cibic Laboratorios, hemos incorporado a nuestro catálogo la prestación 7298- PANEL CÁNCER DE PULMÓN (11 GENES – PCR EN TIEMPO REAL), la cual consiste en un ensayo de PCR en tiempo real que permite la detección cualitativa de 167 alteraciones «hot spots» (SNVs, pequeñas indels y fusiones génicas) en 11 genes drivers (EGFR, ALK, ROS1, KRAS, BRAF, HER2, RET, MET, NTRK1, NTRK2 y NTRK3) utilizando el kit Pan Lung Cancer PCR Panel (AmoyDx).
Prestación disponible en Cibic Laboratorios:
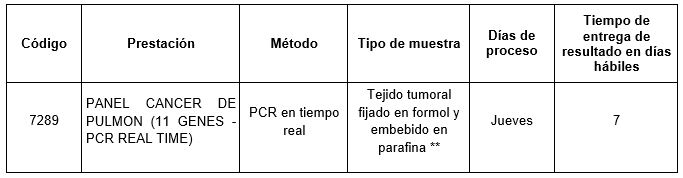
** Se sugiere enviar muestras ≤ 2 años de antigüedad y contenido tumoral > 20%.
Se debe adjuntar el informe anatomopatológico.
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias:
1 – https://www.who.int/news-room/fact-sheets/detail/cancer (último acceso 06/11/2023 10:21 hs).
2 – https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/incidencia (último acceso 06/11/2023 10:21 hs).
3 – https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/mortalidad (último acceso 06/11/2023 10:21 hs).
4 – Howlader N. y cols. SEER Cancer Statistics Review, 1975-2018, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2018/, based on November 2020 SEER data submission, posted to the SEER web site, April 2021.
5 – Araghi, M. y cols. Recent advances in non-small cell lung cancer targeted therapy; an update review. Cancer Cell Int 23, 162 (2023). https://doi.org/10.1186/s12935-023-02990-y
6 – Skoulidis F y cols. Co-occurring genomic alterations in non-small-cell lung cancer biology and therapy. Nat Rev Cancer. 2019 Sep;19(9):495-509. doi: 10.1038/s41568-019-0179-8. Epub 2019 Aug 12. PMID: 31406302; PMCID: PMC7043073.
7 – Guo H. y cols. Biomarker-Targeted Therapies in Non-Small Cell Lung Cancer: Current Status and Perspectives. Cells. 2022 Oct 12;11(20):3200. doi: 10.3390/cells11203200. PMID: 36291069; PMCID: PMC9600447.
8 – Ettinger DS. y cols. NCCN Guidelines® Insights: Non-Small Cell Lung Cancer, Version 2.2023. J Natl Compr Canc Netw. 2023 Apr;21(4):340-350. doi: 10.6004/jnccn.2023.0020. PMID: 37015337.
9 – Hendriks LE. y cols. ESMO Guidelines Committee. Oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023 Apr;34(4):339-357. doi: 10.1016/j.annonc.2022.12.009. Epub 2023 Jan 23. PMID: 36872130.
10- Steuten L. y cols. Cost Effectiveness of Multigene Panel Sequencing for Patients With Advanced Non-Small-Cell Lung Cancer. JCO Clin Cancer Inform. 2019 Jun;3:1-10. doi: 10.1200/CCI.19.00002. PMID: 31242043.
11 – Yan, J.T. y cols. Real-World Biomarker Test Utilization and Subsequent Treatment in Patients with Early-Stage Non-small Cell Lung Cancer in the United States, 2011−2021. Oncol Ther 11, 343–360 (2023). https://doi.org/10.1007/s40487-023-00234-7
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Alan Gomez.
Tel +54 (341) 4861600 (Int. 225)
Sección: Biología Molecular
Lic. Analía Seravalle.
Tel +54 (341) 4861600 (Int 242)

