En la era de la medicina de precisión, la demanda de pruebas para identificar objetivos específicos en muestras citológicas o histológicas ha aumentado drásticamente, impulsada por la identificación de biomarcadores predictivos y el desarrollo de terapias innovadoras. Este avance ha revolucionado la calidad en la atención médica, el diagnóstico, el pronóstico y el tratamiento de los pacientes.
La medicina de precisión abarca tanto la investigación como el tratamiento del cáncer, con el objetivo de desarrollar protocolos más eficaces para la prevención y el manejo de la enfermedad (1). Por ello, la identificación de estrategias válidas y potencialmente aplicables es uno de los principales focos de la investigación oncológica actual, con la finalidad última de su implementación en entornos clínicos (2).
Los receptores TRK son una familia de proteínas transmembrana de unión a neurotrofinas que participan en el desarrollo y diferenciación neuronal, expresados durante el desarrollo embrionario y en el sistema nervioso adulto. Están codificados por tres genes NTRK diferentes, a saber, NTRK1, ubicado en el cromosoma 1q21-q22, NTRK2, en el cromosoma 9q22.1 y NTRK3 en el cromosoma 15q25 (3, 4).
Recientemente, la Administración de Alimentos y Medicamentos (FDA) en EEUU aprobó un inhibidor selectivo de NTRK, larotrectinib (1). Las translocaciones cromosómicas que involucran a los genes NTRK1, NTRK2 y NTRK3 dan como resultado la expresión y activación constitutiva aberrante de quinasas TRK en numerosos tipos de cáncer, con frecuencia variable. En este contexto, la identificación de tumores que albergan fusiones de TRK es crucial.
La primera evidencia del papel de los genes NTRK en el desarrollo del cáncer se remonta a hace más de 30 años, cuando se describieron fusiones NTRK en tumores colorrectales y de tiroides (1). Desde entonces, se han descrito aberraciones en el gen NTRK en múltiples neoplasias adultas y pediátricas (Tabla 1). Las fusiones genéticas representan el mecanismo mejor entendido de activación oncogénica de NTRK. De hecho, las variantes de un solo nucleótido o de empalme alternativo, y las alteraciones del número de copias de genes también se observan esporádicamente, pero su importancia clínica aún es desconocida.
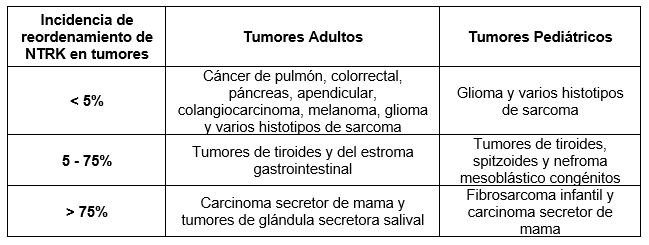 Tabla 1. Grupos de incidencia de reordenamientos de NTRK en tumores de adultos y pediátricos.
Tabla 1. Grupos de incidencia de reordenamientos de NTRK en tumores de adultos y pediátricos.
Los genes de fusión NTRK son el resultado de reordenamientos intra o intercromosómicos, siendo el primero el tipo de evento más común para NTRK1. Varios genes de fusión para NTRK han sido identificados hasta el momento. En todos los casos, los genes híbridos conservan la región 3´ de NTRK, donde se encuentra el dominio de tirosina quinasa, yuxtapuesto a la región 5´ del gen de fusión, que es normalmente una proteína expresada de forma ubicua que contiene dominios de oligodimerización. El resultado es la activación independiente del ligando del dominio tirosina quinasa en el oncogén de fusión expresado de forma aberrante (1).
Las fusiones oncogénicas a NTRK se pueden encontrar en dos escenarios principales diferentes: uno consiste en tumores raros en los que se encuentran fusiones a NTRK en frecuencias muy altas, como oncogenes dominantes (fibrosarcoma infantil, carcinoma secretor mamario, carcinoma secretor de glándulas de saliva, nefroma mesoblástico congénito) mientras que el otro comprende tumores comunes en los que las fusiones a NTRK se identifican en bajas frecuencias, incluidas neoplasias malignas tanto sólidas como hematológicas (1).
La Hibridación In Situ Fluorescente (FISH) es un método basado en sondas de ADN que puede detectar rearreglos génicos utilizando sondas break apart o de partición. Este método tiene varias ventajas, incluida una alta sensibilidad para la detección de puntos de interrupción canónicos y la posibilidad de localizar el objetivo en las células tumorales.
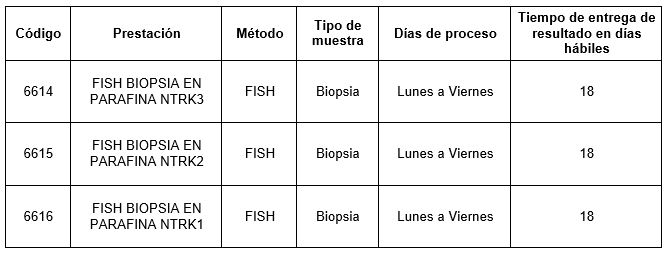
Prestaciones disponibles en Cibic Laboratorios:
Referencias:
1. Zito Marino, F. et al. NTRK Fusions, from the Diagnostic Algorithm to Innovative Treatment in the Era of Precision Medicine. Int. J. Mol. Sci. 21, 3718 (2020).
2. Collins, F. S. & Varmus, H. A new initiative on precision medicine. N. Engl. J. Med. 372, 793–795 (2015).
3. Chao, M. V. Neurotrophin receptors: a window into neuronal differentiation. Neuron 9, 583–593 (1992).
4. Chao, M. V. Neurotrophins and their receptors: a convergence point for many signalling pathways. Nat. Rev. Neurosci. 4, 299–309 (2003).
Para mayor información o consultas:
Sección: Citogenética
Dr. Mariano Gonzalez
Tel: 0341-4861600. Int: 227

