Las proteínas hem, mioglobina y hemoglobina, mantienen un aporte de oxígeno esencial para el metabolismo oxidativo. La mioglobina, una proteína monomérica del tejido muscular rojo, almacena oxígeno como una reserva contra la privación del mismo. La Hemoglobina, una proteína tetramérica de los eritrocitos, transporta O2 hacia los tejidos, y regresa CO2 y protones hacia los pulmones.
Las notorias propiedades de la hemoglobina son consecuencia de su estructura cuaternaria. Esta es un tetrámero compuesto de pares de dos diferentes subunidades polipeptídicas (fig). La composición de subunidad principales son α2β2 (HbA, hemoglobina del adulto), α2γ2 (HbF, hemoglobina fetal), α2βS2 (HbS, hemoglobina de células falciformes) y α2δ2 (HbA2, una hemoglobina menor del adulto). La composición de subunidad de tetrámeros de hemoglobina sufre cambios complejos durante el desarrollo. El feto humano en un inicio sintetiza un tetrámero ξ2ε2. Hacia el final del primer trimestre, las subunidades ξ y ε han quedado remplazadas por subunidades α y γ, lo que forma HbF, la hemoglobina de etapas avanzadas de la vida fetal. Si bien la síntesis de subunidades β empieza durante el tercer trimestre, las mismas no reemplazan por completo a las subunidades γ para producir HbA del adulto sino hasta algunas semanas después del parto.
Se han identificado muchas mutaciones que afectan las hemoglobinas humanas. Las mutaciones en los genes que codifican para las subunidades α o β de la hemoglobina tienen el potencial de afectar su función biológica. Cuando esto ocurre el estado recibe el nombre de hemoglobinopatía. Se estima que más del 7% de la población mundial es portadora de trastornos de la hemoglobina.
Dos tipos de trastornos pueden afectar a las cadenas de globina: cualitativos y cuantitativos.
Dentro de los primeros, encontramos a las hemoglobinopatías, resultado de las siguientes alteraciones:
– sustitución de un aminoácido por otro
– eliminación de una porción de la secuencia de aminoácidos
– hibridación anormal entre dos cadenas durante la meiosis
– alargamiento anormal de la cadena de globina.
En los segundos trastornos tenemos a las talasemias que afectan la tasa de la síntesis de la hemoglobina. La β-talasemia heterocigota es una condición benigna con anemia leve, hipocromía y microcitosis, y un elevado nivel de HbA2. En comparación, la enfermedad grave, β-talasemia mayor requiere transfusiones de sangre toda la vida y terapia de quelación de hierro.
En el laboratorio, el estudio electroforético de las hemoglobinas es necesario fundamentalmente para:
• Confirmar un diagnostico provisional, tal como la enfermedad de células falciformes o la β-talasemia mayor.
• Explicar una anormalidad hematológica, como anemia o microcitosis.
• Identificar los fetos en riesgo de hemoglobinopatías y ofrecer a los padres asesoramiento genético.
Paralelamente a las técnicas de electroforesis en diferentes soportes, en los que se incluyen al gel de agarosa, se ha desarrollado la técnica de electroforesis capilar (EC), que ofrece las ventajas de una automatización completa del análisis, separación rápida y una excelente resolución. Se define como una técnica de separación electrocinética realizada en un tubo de diámetro interno inferior a 100 μm lleno de un tampón compuesto por electrolitos.
El sistema de electroforesis capilar utilizado en Cibic, denominado CAPILLARYS 2 Flex Piercing (ver fotografía debajo), usa el principio de la electroforesis capilar en solución libre, que representa la forma más corriente de EC.

Fotografía: Capillarys 2 Flex Piercing de Sebia.
Permite la separación de moléculas cargadas en función de su movilidad electroforética propia en un tampón de pH dado y, según el pH del electrolito, de un flujo electroendosmótico más o menos importante. El sistema CAPILLARYS 2 posee una serie de capilares en paralelo, permitiendo realizar 7 análisis simultáneos. En este sistema, la inyección en los capilares de las muestras diluidas con solución hemolizante se realiza en el ánodo por aspiración. La separación se realiza a continuación aplicando una diferencia de potencial de varios miles de voltios en los extremos de cada capilar. La detección directa de las hemoglobinas se efectúa a 415 nm en el lado catódico. Los capilares se lavan antes de cada análisis con una solución de lavado, y luego con el tampón de análisis. Con el tampón de pH alcalino usado, el orden de migración de las principales hemoglobinas normales y anormales es el siguiente, del cátodo al ánodo: δA’2 (variante A2), C, A2/O-Arab, E, S, D, G-Filadelfia, F, A, Hope, Bart, J, N-Baltimore y H.
Cabe señalar que la identificación de hemoglobina es a menudo presuntiva, basada en la movilidad electroforética u otras características de un individuo con historia familiar procedente. Se debe realizar un mínimo de dos técnicas basadas en diferentes principios. La identificación definitiva por lo general requiere el análisis de ADN, espectrometría de masas o secuenciación de proteínas.
Prestación disponible en Cibic:
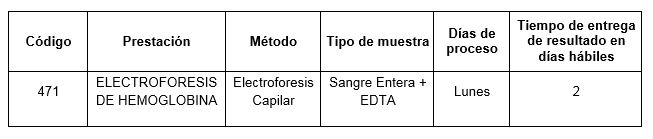
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn . Principios de Bioquímica – Cuarta Edición – 2008
2- Sorroche P., Saez M. S. – La electroforesis capilar en el estudio de las Hemoglobinopatias y Talasemias – 2014
Para mayor información o consultas:
Sección: Producción Bioquímica Clínica – PBC
Bioq. María Florencia Mora Dengra
Tel: 0341- 4722424 – Int 222.
Sección: Producción Bioquímica Clínica – PBC
Bioq. Florencia Fernández
Tel: 0341-4722424. nt: 226.
