La trisomía es la anormalidad cromosómica más comúnmente identificada en humanos, constituyendo la principal causa de la pérdida del embarazo. Sin embargo, algunos fetos trisómicos llegan a término y, en este caso, esta patología es la más asociada a retraso mental (1).
Las trisomías más comunes son:
Trisomía 21
La trisomía 21, causa más común del síndrome de Down, constituye la aneuploidía más común entre los nacidos vivos y una de las principales causas de discapacidad intelectual. Resulta del desequilibrio de dosis de genes ubicados en el cromosoma 21 humano debido a una falla en la separación del cromosoma durante el desarrollo de óvulos o espermatozoides; o bien, en el caso de mosaicismo, a la segregacion errónea que ocurre después de la fertilización en algún momento durante el desarrollo embrionario. La incidencia está influenciada por la edad materna y difiere en la población (entre 1 en 319 y 1 en 1000 nacidos vivos) (2).
Estos pacientes tienen alta complejidad genética y variabilidad fenotípica. Algunas personas se ven afectadas por fenotipos variantes que incluyen hipotonía, defectos del tabique auriculoventricular en el corazón, leucemia megacarioblástica aguda o leucemia linfoblástica aguda, Alzheimer y enfermedad de Hirschsprung. También pueden presentar una variedad de características físicas como mentón pequeño, ojo inclinado, tono muscular deficiente, un puente nasal plano, un solo pliegue de la palma y una protuberancia debido a la boca pequeña y la lengua grande. Otras características incluyen patrón anormal de huella digital y dedos cortos.
Los fetos trisómicos tienen un riesgo elevado de abortos involuntarios y las personas adultas tienen una mayor incidencia de desarrollar varias afecciones médicas. El avance reciente en el tratamiento médico con apoyo social ha aumentado la esperanza de vida de la población con síndrome de Down (2).
Trisomía 18
El síndrome de trisomía 18, también conocido como síndrome de Edwards, es un trastorno cromosómico común debido a la presencia de un cromosoma 18 adicional, ya sea trisomía completa, mosaico o trisomía 18q parcial. Es el segundo síndrome de trisomía autosómica más común después de la trisomía 21. La prevalencia de vida se estima en 1 / 6000 – 1 / 8000, pero la prevalencia general es más alta (1 / 2500 – 1 / 2600) debido a la alta frecuencia de pérdida fetal y terminación del embarazo después del diagnóstico prenatal. La prevalencia de la trisomía 18 aumenta con la edad materna avanzada. El riesgo de recurrencia para una familia con un niño con trisomía 18 completa es aproximadamente del 1%.
La característica del síndrome consiste en anomalías mayores y menores, deficiencia de crecimiento prenatal y postnatal, un mayor riesgo de mortalidad neonatal e infantil y una marcada discapacidad psicomotora y cognitiva. Las anomalías menores típicas incluyen rasgos craneofaciales característicos, puño cerrado con dedos sobresalientes, uñas pequeñas, pulgares subdesarrollados y esternón corto. La presencia de malformaciones importantes es común, y las más frecuentes son las anomalías cardíacas y renales (3).
Trisomía 13
La trisomía 13 es una alteración cromosómica, en la que se presenta un cromosoma 13 adicional. Tiene una incidencia de 1 en 10,000 a 20,000 nacimientos. Puede ocurrir de forma completa, parcial o en mosaicismo. Este último caso ocurre cuando, en un individuo, un porcentaje de células son trisómicas para el cromosoma 13 mientras que el resto son euploides, y corresponde solamente al 5% de todos los casos.
Los pacientes que padecen trisomía 13 presentan una expresividad variable, que va desde malformaciones graves con muerte temprana (fenotipo similar a la forma completa y más frecuente) hasta un desarrollo normal y pocos hallazgos dismórficos.
Dicha alteracion identificada por Patau en 1960, no presenta predominio por sexo y se encuentra en el 1% de los abortos espontáneos (100 veces más que en los nacidos vivos). Corresponde a la tercera trisomía autosómica más común en recién nacidos, después de las trisomías 21 y 18.
La tasa de mortalidad es aproximadamente del 50% en el primer mes de vida y del 90% durante el primer año debido a la severidad de las alteraciones en el sistema nervioso central, cardiopatías congénitas y complicaciones respiratorias. En comparación con la forma completa, la expresividad variable en el mosaicismo de trisomía 13 puede incluir, además, pigmentación cutánea inusual y mayor supervivencia. La razón de esta variación es que el fenotipo se modifica de acuerdo con la distribución de las células con la alteración cromosómica en tejidos específicos. Sin embargo, puede no ser atribuido completamente a este factor (4).
Cibic dispone de distintas prestaciones para el diagnóstico de dichas patologías; en primera instancia se realiza un cariotipo en sangre periférica, del cual se pueden obtener distintos resultados:
– Todas las células analizadas presentan la alteración.
– Solo una parte de las células analizadas presenta la alteración (mosaicismo).
– Cariotipo normal.
Para determinar el grado de mosaicismo, o bien, si la clínica del paciente lo sugiere se debe realizar hibridación in situ fluorescente (FISH) para el cromosoma en estudio. Su principal ventaja es que se pueden evaluar mayor número de células y realizarse sobre núcleos en interfase.
El FISH es una técnica que detecta secuencias de ADN en células o tejidos preservados mediante el empleo de una sonda (fragmento de ADN homólogo a la secuencia blanco) marcada con un fluorocromo, la cual va dirigida hacia un lugar específico del ADN y que emite fluorescencia que puede ser observada por medio de un microscopio de epifluorescencia. Esta se fundamenta en la capacidad que poseen los ácidos nucleicos para hibridarse entre sí, es decir, la existencia de determinada secuencia de ADN, que resulta complementaria con otra secuencia.
Se utilizan sondas de DNA específicas para regiones peri-centroméricas. Debido a que no involucran ningún tipo de secuencias satélites su especificidad es muy alta aún en condiciones de baja astringencia. En interfases generan señales definidas y de menor tamaño que las clásicas sondas satelitales, disminuyendo notablemente la superposición y, como consecuencia, los errores de interpretación. Esta técnica es de gran utilidad ya que al analizar mayor número de células es posible detectar alteraciones en muy baja proporción.
Prestaciones disponibles en Cibic:
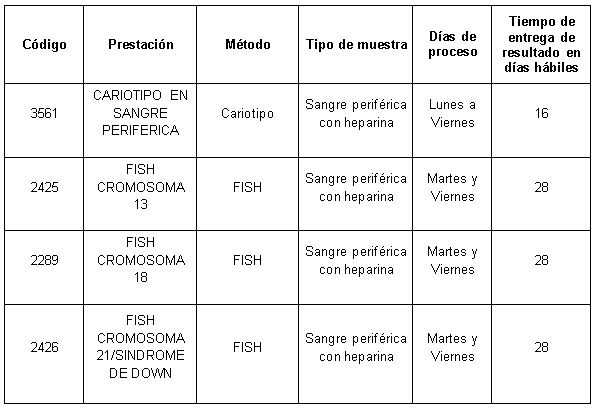
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1- Terry Hassold, P&ricia A. Hunt and Stephanie Sherman
Case Western Reserve University, Cleveland, and Emory University, Atlanta, USA. Trisomy in humans: incidence, origin and etiology. 1993
2- Ambreen Asim, Ashok Kumar, Srinivasan Muthuswamy, Shalu Jain and Sarita Agarwal. “Síndrome de Down: una idea de la enfermedad”.2015
3- Anna Cereda yJohn C Carey. El síndrome de trisomía 18. 2012
4- Francisco Cammarata-Scalisi1*, Dianora Araque1, Rosmary Ramírez2, Luis Guaran3 y Gloria Da Silva1 1Unidad de Genética Médica, Departamento de Puericultura y Pediatría, Universidad de Los Andes, Mérida; 2Centro de Recuperación Nutricional Infantil Dr. Pastor Oropeza, San Cristóbal, Táchira; 3Hospital Central de San Cristóbal, San Cristóbal, Táchira. Venezuela – Mosaicismo de trisomía 13. 2019
Para mayor información o consultas:
Sección: Citogenética
 Bioq. Bertalot, Sibila
Bioq. Bertalot, Sibila
Tel: 0341-472424 Int: 283
 Lic. Vanrell, Veronica
Lic. Vanrell, Veronica
Tel: 0341-472424 Int: 283

