La isocitrato deshidrogenasa (IDH) es una enzima clave involucrada en la conversión de isocitrato en α-cetoglutarato (α-KG) en el ciclo del ácido tricarboxílico (TCA). En los eucariotas existen al menos tres isozimas de la IDH (IDH1, IDH2 e IDH3).
Se han identificado mutaciones en IDH1 e IDH2 en múltiples tipos de tumores, incluidos astrocitomas y oligodendrogliomas de grado II / III y glioblastomas secundarios (GBM). También se han identificados mutaciones IDH1 e IDH2 recurrentes en leucemia mieloide aguda (LMA), síndromes mielodisplásicos (MDS), neoplasias mieloproliferativas (MPN) y colangiocarcinoma (1).
Las mutaciones IDH1 e IDH2 confieren actividad neomórfica a la proteína, lo que resulta en la conversión de αKG en el oncometabolito, D-2-hidroxiglutarato (2-HG). La acumulación subsiguiente de 2-HG da como resultado una desregulación epigenética mediante la inhibición de las histonas dependientes de αKG y las desmetilasas de ADN, y un bloqueo en la diferenciación celular (1).
Mutaciones en IDH1 e IDH2 y LMA
Mutaciones somáticas en IDH1 e IDH2 se observan en hasta el 20% de los pacientes con LMA y ocurren como eventos clonales tempranos en la evolución de la enfermedad. Las mutaciones en IDH2 son más frecuentes en la LMA y afectan a 8 a 19% de los pacientes, con una prevalencia creciente en las poblaciones de pacientes de riesgo intermedio y de edad avanzada.
Las mutaciones en IDH1 están presentes en hasta el 7–14% de los pacientes con LMA y más comúnmente implican una sustitución de cisteína o histidina por arginina en el residuo 132, R132C y R132H, respectivamente (2).
Las mutaciones de IDH2 ocurren en uno de los dos hot spots de arginina dentro del sitio activo enzimático, el más común de los cuales es el residuo R140, mutado en aproximadamente el 80% de los casos, seguido del residuo R172.
Algunos pacientes con LMA con mutación IDH, especialmente la mutación IDH2 R172, tienen una mala respuesta a la quimioterapia tradicional y tienen una tasa de recaída más alta. Por lo tanto, el tratamiento individualizado, especialmente la terapia dirigida para las mutaciones de IDH, puede ser una opción importante para estos pacientes. En los últimos años, los inhibidores de IDH han mostrado una buena respuesta clínica en pacientes con LMA (3).
Mutaciones en IDH1 e IDH2 y gliomas de bajo grado y GBM secundarios
Las mutaciones en IDH se encuentran en > 80% de los gliomas de bajo grado y GBM secundarios, pero en <10% de los GBM primarios. En la actualidad existe un consenso generalizado de que la mutación de IDH es un marcador molecular definitivo de gliomas de bajo grado y GBM secundarios, y es más objetivo que los diagnósticos clínicos y patológicos estándar para distinguir entre GBM primarios y secundarios de novo (1).
Las mutaciones en gliomas de bajo grado y GBM secundarios en IDH1 ocurren predominantemente en la arginina 132 dando como resultado sustituciones, incluyendo R132H (más común, 88%), R132C, R132L, R132S y R132G.
Las mutaciones de IDH2 ocurren típicamente en R140 o R172, siendo la R172K la más común. Es importante destacar que las mutaciones IDH1 e IDH2 son mutuamente excluyentes (4).
Además del valor diagnóstico, las mutaciones en IDH1 e IDH2 se han asociado con un mejor resultado y una supervivencia más prolongada en pacientes con gliomas de bajo grado, astrocitomas anaplásicos y GBM, y se ha demostrado que son un poderoso factor pronóstico independiente para una supervivencia prolongada (5).
En Cibic Laboratorios contamos con la determinación “Mutaciones en IDH1/2” en la cual, mediante secuenciación Sanger, evaluamos los nucleótidos que codifican los residuos de arginina en la posición 132 (R132) de IDH1 y 172 (R172) de IDH2.
Prestación disponible en Cibic Laboratorios:
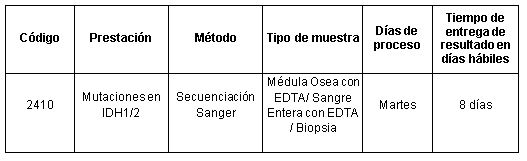
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1 – Dang L, Yen K, Attar EC. IDH mutations in cancer and progress toward development of targeted therapeutics. Ann Oncol. 2016;27(4):599-608. doi:10.1093/annonc/mdw013.
2 – Montalban-Bravo G, DiNardo CD. The role of IDH mutations in acute myeloid leukemia. Future Oncol. 2018;14(10):979-993. doi:10.2217/fon-2017-0523.
3 – Liu, X., Gong, Y. Isocitrate dehydrogenase inhibitors in acute myeloid leukemia. Biomark Res 7, 22 (2019). https://doi.org/10.1186/s40364-019-0173-z.
4 – Han CH, Batchelor TT. Isocitrate dehydrogenase mutation as a therapeutic target in gliomas. Chin Clin Oncol. 2017;6(3):33. doi:10.21037/cco.2017.06.11.
5 – Horbinski C, Kelly L, Nikiforov YE, Durso MB, Nikiforova MN. Detection of IDH1 and IDH2 mutations by fluorescence melting curve analysis as a diagnostic tool for brain biopsies. J Mol Diagn. 2010;12(4):487-492. doi:10.2353/jmoldx.2010.090228
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Alan Gomez.
Tel 0341-4722424. Interno: 243/225
Sección: Biología Molecular
Lic. Analía Seravalle.
Tel 0341-4722424. Interno: 242.

