Helicobacter pylori (H. pylori) es una bacteria gram negativa, microaerófila, usualmente espiralada cuyo nicho ecológico es el estómago humano.
Se la asocia etiológicamente con úlceras pépticas de estómago o duodeno, carcinomas gástricos y linfomas gástricos. El descubrimiento incidental de esta bacteria en 1983, que valió en 2005 el Premio Nobel de Medicina para sus descubridores, cambió el entendimiento sobre las enfermedades ácido-pépticas.
La prevalencia global de la infección por H. pylori es más del 50%. La misma es altamente variable en relación a la geografía, etnia, edad, género y condiciones socioeconómicas (alta en países en desarrollo y baja en países industrializados) (1).
H. pylori se encuentra casi exclusivamente en humanos y algunos primates no humanos, raramente se ha aislado de otros animales. Si bien se desconoce el mecanismo exacto, H. pylori se transmite mayoritariamente por vía oral-oral o fecal-oral (2).
H. pylori está altamente adaptada al nicho gástrico, con características únicas que permiten su entrada al mucus, acoplamiento a las células epiteliales y evasión de la respuesta inmune, resultando en una colonización persistente (3).
H. pylori se adquiere habitualmente en la infancia. La colonización de la mucosa gástrica resulta primariamente en la inducción de una respuesta inflamatoria. La gastritis aguda inicial es seguida de una gastritis crónica que se desarrollará en casi todas las personas colonizadas persistentemente y que puede durar toda la vida si la infección no es tratada. Sin embargo, el 80-90% no presentará síntomas. El posterior curso clínico de la infección por H. pylori es altamente variable, influenciado tanto por factores microbianos como del hospedador (3). La permanencia de H. pylori causa una respuesta proinflamatoria prolongada que acoplada a un daño celular inicia la cascada histológica que en raros casos puede terminar en cáncer gástrico (1).
La colonización por H. pylori no es una enfermedad en si misma pero es una condición que afecta el riesgo relativo de desarrollar varios desórdenes clínicos del tracto gastrointestinal superior y posiblemente el tracto hepatobiliar. La búsqueda de H. pylori no tiene relevancia por si sola sino que debe desarrollarse para encontrar la causa de una condición subyacente, como una úlcera péptica o con el propósito de prevención de enfermedad, como en los sujetos con cáncer gástrico familiar. En estos casos, un resultado positivo justifica el tratamiento y uno negativo podría indicar la necesidad de búsqueda de otros factores etiológicos o medidas preventivas (3).
El tratamiento busca la completa eliminación de la bacteria. Luego, la tasa de reinfección es baja por lo que los efectos de tratamientos son duraderos. Para favorecer la efectividad de los antimicrobianos generalmente las terapias son combinadas con dos antibióticos y algún agente antisecretorio, con una extensión del tratamiento de entre 7 a 14 días (3).
MÉTODOS PARA DIAGNOSTICAR LA INFECCIÓN POR H. pylori:
La infección por H. pylori puede ser diagnosticada por métodos no invasivos (no requieren endoscopía) o por biopsia endoscópica de la mucosa gástrica. Cada test tiene su utilidad y sus limitaciones en diferentes situaciones clínicas (4). En la elección de la metodología apropiada se debe tener en cuenta el objetivo del diagnóstico (epidemiológico, diagnóstico o de seguimiento) y contexto clínico del paciente.
Mientras que todos los métodos pueden servir para diagnosticar la infección por H. pylori (con diferentes porcentajes de sensibilidad y especificidad), la endoscopía con toma de biopsia para estudio histológico permite además diagnosticar el tipo de enfermedad.
Los métodos no invasivos incluyen el test del aliento, pruebas serológicas y la detección de antígenos en materia fecal:
La prueba del aliento se basa en la abundancia de la actividad ureasa de H. pylori en el estómago. Esta pruebas tiene una buena sensibilidad y especificidad para el diagnóstico y seguimiento del tratamiento realizado 4 a 6 semanas después de finalizado, con la salvedad de que pueden existir otras bacterias productoras de ureasa en el estómago.
La determinación serólogica de anticuerpos anti-Helicobacter pylori se puede utilizar como un rápido screening para grandes poblaciones de pacientes y es un gran indicador de diagnóstico temprano de infección por Helicobacter ya que la respuesta inmune puede generalmente preceder a las manifestaciones clínicas de la enfermedad. Altos títulos de IgM e IgA indican infección inicial o activa, mientras que altos niveles de IgG pueden indicar infección activa o resuelta. Su determinación resulta muy útil también para monitorizar el tratamiento de pacientes dispépsicos.
La detección de antígeno en heces es un método directo que permite la detección de antígeno de H. pylori en muestras de heces, está asociado a baja sensibilidad a pesar de ser específica. Se ha descrito como válida para establecer el diagnóstico inicial, verificar la eficacia del tratamiento en las 4 a 6 semanas posteriores a su realización y comprobar la reaparición de una infección.
El estudio histológico de la biopsia endoscópica permite conocer las lesiones de la mucosa además de detectar la infección por H. pylori. Sin embargo esta metodología es dependiente del operador. Sobre las biopsias también puede realizarse el test rápido de la ureasa para detectar la actividad enzimática, pero es de baja sensibilidad especialmente cuando hay baja carga bacteriana.
El aislamiento mediante cultivo de H. pylori a partir de la biopsia es sin duda el método más específico en el diagnóstico del microorganismo. No obstante su sensibilidad varía notablemente en relación con diferentes variables como la recolección, transporte y almacenamiento de la muestra, los medios de cultivo utilizados y las condiciones de incubación. Se puede considerar como un método tedioso e incluso de difícil realización (5).
En los últimos años se han desarrollado técnicas que permiten detectar la presencia del ADN de H. pylori mediante PCR directamente en la biopsia gástrica pero también en otras muestras como heces. Mediante la detección de genes conservados específicos de H. pylori, la PCR provee excelente sensibilidad y especificidad en comparación con otros métodos convencionales. Entre otras ventajas se encuentran la falta de condiciones especiales para la recolección y el transporte de la muestra y la rapidez en la obtención del resultado.
Esta metodología puede aplicarse para el diagnóstico de la infección como así también para verificar la erradicación después del tratamiento. Además, permite la detección de algunas mutaciones que llevan a resistencia a antibióticos y a la detección de factores de virulencia (4).
En el Laboratorio Cibic actualmente realizamos la detección del ADN de H. pylori mediante PCR en tiempo real.
Prestaciones disponibles en Cibic:
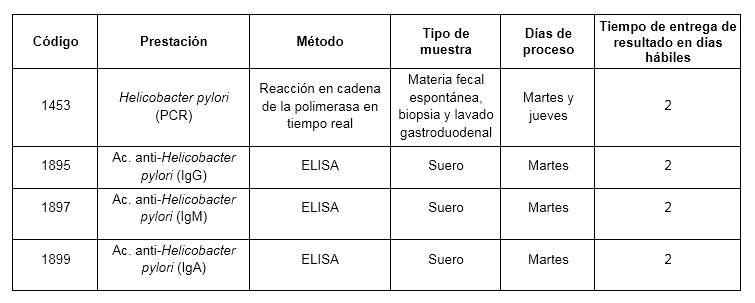
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte a la extranet y al manual de prestaciones.
Referencias:
1- Kusters et al. Pathogenesis of Helicobacter pylori Infection (2006). Clin. Microbiol. Reviews 19: 449–490.
2- Hunt, RH et al Helicobacter pylori in developing countries (2010) World Gastroenterology Organisation Global Guidelines.
3- Suerbaum S. et al. Helicobacter pylori Infection (2002) New England Journal of Medicine, 347 1175-1186.
4- Wang Y. et al. Diagnosis of Helicobacter pylori infection: Current options and developments (2015) World Journal of Gastroenterology 21: 11221-11231).
5- Alarcón T et al. Diagnóstico Microbiológico de H. pylori (2004) SEIMC-Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica-Procedimientos en Microbiología Clínica Cap.17.
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Javier Sfalcin.
Dra. Mariela Sciara.
Teléfono: 0341- 4499444. Internos: 225/240/243

