El virus de la Hepatitis E (HEV) es un pequeño virus (27-32 nm de diámetro) de genoma de ARN monocatenario perteneciente a la familia Hepaviridae (1).
Se conocen 8 genotipos de HEV capaces de infectar una amplia gama de especies. Los genotipos que generan infecciones en humanos son los genotipos 1, 2, 3, 4, y 7.
Los genotipos 1 y 2 están restringidos únicamente a humanos y son los responsables de grandes brotes epidémicos en países en desarrollo (2). La infección se adquiere al consumir agua contaminada con materia fecal.
Por el contrario los genotipos 3, 4 y 7 se transmiten principalmente por vía zoonótica a través del consumo de productos de origen animal deficientemente cocidos (el HEV puede inactivarse calentando a 71 ° C durante 20 min), mayormente carne de cerdo y sus derivados, y están asociados a casos de hepatitis esporádicos o agrupados en países industrializados. En dichos países se ha detectado además, transmisión de los genotipos 3, 4 y 7 por medio de transfusiones sanguíneas y trasplante de órganos sólidos de pacientes infectados (3, 4).
La carga global del HEV es considerablemente alta, se estima que cada año ocurren alrededor de 20 millones de nuevas infecciones, 3,3 millones son casos sintomáticos y 60.000 casos fatales que son atribuidos principalmente a los genotipos 1 y 2 (5, 6).
El HEV afecta principalmente al hígado, aunque también se lo ha asociado con varios síntomas extra hepáticos como pancreatitis, síntomas neurológicos, trastornos hematológicos entre otros (7).
Se manifiesta con mayor frecuencia como una hepatitis aguda auto limitada, con síntomas de anorexia, náuseas, vómitos, malestar general, dolor abdominal e ictericia que dura típicamente ≤1 mes. Es clínicamente indistinguible de la infección por el virus de la hepatitis A (VHA) y se asocia con una mortalidad del 1 – 2% en pacientes inmunocompetentes (5).
Una consecuencia clínica poco conocida del HEV es su efecto severo en las mujeres embarazadas, en quienes puede causar insuficiencia hepática aguda, hemorragia y muerte fetal intrauterina y resultar en hasta un 25% de mortalidad en el tercer trimestre. Los mecanismos de esta virulencia exacerbada se desconocen hasta la actualidad, aunque podrían estar relacionados a cambios hormonales y/o inmunológicos asociados al embarazo (8). La infección aguda también se ha asociado con una alta mortalidad entre los niños menores de 2 años de edad y es más grave entre los pacientes con enfermedad hepática preexistente.
Los genotipos 3, 4 y 7 del HEV pueden generar una infección crónica en pacientes inmunocomprometidos, como receptores de trasplantes de órganos e individuos infectados con HIV. Estos pacientes corren un mayor riesgo de desarrollar infección crónica y progresión rápida a cirrosis (1, 4).
En Argentina la información es escasa en cuanto a prevalencia y circulación. Un estudio halló RNA de HEV en 6,3% de aguas residuales sin tratar y en 3,2% de muestras fluviales. En todos los casos del genotipo 3 del virus. Ese mismo estudio determinó una prevalencia del 4,4 % de IgG anti-HEV en la población estudiada. Estos hallazgos infieren sobre una importante circulación del virus en nuestra región, precisamente de un genotipo de riesgo de transmisión zoonótica. Se evidencia la necesidad además, de incluir al HEV en los algoritmos de diagnostico al considerar una posible hepatitis de origen viral (9).
Actualmente no existe ningún tratamiento de acción directa contra el HEV, por lo cual este sigue siendo un problema importante de salud pública, principalmente en mujeres embarazadas y pacientes inmunocomprometidos. En estos últimos el tratamiento de elección es la monoterapia con Ribavirina, aunque la misma está fuertemente contraindicada para su uso en mujeres embarazadas (10). Resulta crítico ante este escenario contar con herramientas que permitan un diagnostico rápido y preciso, a fines de poder decidir el manejo médico más adecuado.
La respuesta serológica anti-HEV en pacientes presenta un patrón serológico clásico de anti-VHE IgM e IgG detectable generalmente en el momento de la aparición de la enfermedad (12, 13). La IgM anti-HEV aparece durante la fase aguda de la enfermedad tan precozmente como a los 4 días del inicio de la ictericia. Se detecta en >90% de los pacientes en las 2 primeras semanas tras la aparición de la enfermedad, con el pico en el periodo sintomático, y permanece detectable 4-5 meses.
El ARN-HEV se puede detectar en suero y heces durante la fase aguda de la infección e incluso antes de la elevación de ALT mediante RT-PCR (unas 2 semanas en suero y unas 4 en heces, con casos de 8 a 12 semanas), la detección de ARN-HEV permite establecer la replicación viral.
En CIBIC contamos con un método de detección de ARN-HEV cualitativa en tiempo real, una one-step RT-PCR (retrotranscripción seguida de amplificación mediante PCR) con sondas de hidrólisis contra un fragmento de la región ORF3 del genoma de HEV que permite evidenciar o descartar la presencia del virus en los estadios iníciales en forma rápida, con buena sensibilidad y especificidad. Además contamos con métodos serológicos como un ELISA para detección de anticuerpos IgM anti-HEV y un ensayo Inmunoblot para la detección de anticuerpos IgG e IgM anti-HEV, útiles para detección de la infección en la etapa de negativización del ARN-HEV.
Prestaciones disponibles en Cibic:
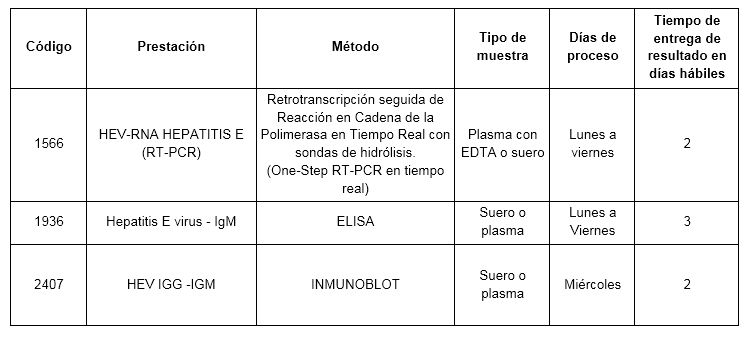
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias:
1. Nimgaonkar I. et al. Hepatitis E virus: advances and challenges. Nat Rev GastroenterolHepatol.2018 Feb;15(2):96-110.
2. Khuroo, M. S., Khuroo, M. S. &Khuroo, N. S. Hepatitis E: discovery, global impact, control and cure. World J. Gastroenterol. 22, 7030–7045 (2016).
3. Meng, X. J. Zoonotic and foodborne transmission of hepatitis E virus. Semin. LiverDis. 33, 41–49 (2013).
4. Kamar, N. et al. Hepatitis E virus and chronic hepatitis in organ-transplant recipients. N. Engl. J. Med. 358, 811–817 (2008).
5. Rein, D. B., Stevens, G. A., Theaker, J., Wittenborn, J. S. &Wiersma, S. T. The global burden of hepatitis E virus genotypes 1 and 2 in 2005. Hepatology55, 988–997 (2012).
6. World Health Organization. Hepatitis E. WHO http://www.who.int/mediacentre/factsheets/fs280/en/ (2015).
7. Pischke, S. et al. Hepatitis E virus: Infection beyond the liver? J. Hepatol. 66, 1082–1095 (2017).
8. Perez-Gracia, M. T., Suay-Garcia, B. & Mateos-Lindemann, M. L. Hepatitis E and pregnancy: currentstate. Rev. Med. Virol. http://dx.doi.org/10.1002/ rmv.1929 (2017).
9. Martínez Wassaf MG, et al. First detection of hepatitis E virus in Central Argentina: Environmental and serological survey. J Clin Virol (2014).
10. Kamar, N. et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients. N. Engl. J. Med. 370, 1111–1120 (2014).
11. Khudyakov Y, Kamili S. Serological diagnostics of hepatitis E virus infection. Virus Res. 2011;161:84–92.
12. Francisco Rodríguez-Frias y cols. Hepatitis E: virología molecular, epidemiología y patogénesis. Enferm Infecc Microbiol Clin. 2012;30(10):624–634.
13. Krawczynski K, Meng XJ. Rybcznska. Pathogenicelements of hepatitits E and animal models of HEV infection. Virus Res. 2011;161:78–83.
Para mayor información o consultas:
Sección: Biología Molecular.
Lic. Javier Alejandro Sfalcin. Tel: 0341 4499444. Int: 241.
Lic. Alan Gómez. Tel: 0341 4499444.Int: 243.
Sección: Bioquímica Clínica no Automatizada.
Bioq. María Florencia Mora Dengra.Tel: 0341 4499444. Int: 222.

