El Síndrome de Pallister-Killian (PKS) fue descrito por primera vez en 1977 por el médico estadounidense Philip Pallister y más tarde en 1981 por el médico austriaco Wolfgang Killian. PKS es un trastorno cromosómico raro que se produce por la presencia de un pequeño cromosoma metacéntrico supernumerario formado por dos brazos cortos p del cromosoma 12 que ocasiona una tetrasomía de 12p en mosaico (isocromosoma i12p). El porcentaje de células anormales no se ha relacionado con la gravedad clínica.
El diagnóstico puede ser un desafío debido a que puede presentar una ecografía prenatal normal y una expresión clínica leve, o bien, puede mostrar polihidramnios, micromelia rizomélica o macrosomía, y la sospecha se produce desde la fase intrauterina (1). En la fase extrauterina, el PKS se caracteriza por dismorfismo craneofacial, anomalías pigmentarias de la piel, defectos cardíacos, hernia diafragmática congénita, hipotonía, discapacidad intelectual y epilepsia. El examen de la cabeza puede ser la clave para el diagnóstico: hipertelorismo, nariz pequeña, filtrum largo, labio superior en forma de V (“Pallister lip”), implantación baja de orejas y rotadas posteriormente, alopecia frontotemporal bilateral y facies tosca (más pronunciados con la edad) son característicos. El aumento de la edad materna es un factor de riesgo independiente para PKS (2).
La presencia del isocromosoma extra se puede observar por cariotipo con bandeo G (Figura 1), por medio de FISH (Hibridación fluorescente in situ) con sondas específicas para la región 12p, o bien, mediante el análisis por CGH-array. De esta manera podemos identificar la tetrasomía en sangre periférica y facilitar así el diagnóstico en aquellos casos en los que la sospecha clínica no lleva a la biopsia de piel para la obtención de fibroblastos. Sin embargo, la detección de i12p en la sangre rara vez se logra en el primer año de vida y, a partir de entonces, se convierten en células muy difíciles de detectar (3).

Figura 1: Cariotipo con bandeo G donde se observa el isocromosoma 12p.
Métodos no invasivos como el de mucosa bucal, con una tasa de detección de entre 50–100%, son una herramienta válida y prometedora para detectar i12p. En recién nacidos, cariotipos de muestras de sangre periférica puede detectar i12p en una tasa porcentual baja. Por tal motivo, en pacientes mayores, cultivos de fibroblastos de piel o mucosa bucal son los métodos recomendados para diagnosticar PKS.
El FISH es una técnica que detecta secuencias de ADN en células o tejidos preservados mediante el empleo de una sonda (fragmento de ADN homólogo a la secuencia blanco) marcada con un fluorocromo, la cual va dirigida hacia un lugar específico del ADN y que emite fluorescencia que puede ser observada por medio de un microscopio de epifluorescencia. Esta se fundamenta en la capacidad que poseen los ácidos nucleicos para hibridarse entre sí, es decir, la existencia de determinada secuencia de ADN, que resulta complementaria con otra secuencia (4). Su principal ventaja es que puede aplicarse sobre células en interfase (en el caso de mucosa bucal no requiere cultivo) y facilita su análisis sobre un mayor número de células. Es una técnica sensible y especifica.
Para la detección de PKS se utiliza una sonda locus específica, las cuales son diseñadas para detectar específicamente la falta o duplicación de un gen o una región crítica, asociada a un síndrome en particular. Hibridan completamente la región cromosómica target dando una señal clara y brillante. Un núcleo normal mostrará 2 señales, mientras que, si el gen está duplicado, el patrón de señales esperado es distinto de 2 (en este caso es de 4, ver Figura 2). Vienen acompañadas de una sonda control que hibrida sobre el mismo cromosoma, pero en una región distante.

Figura 2: FISH realizado sobre sangre periférica. Se puede observar a la derecha una célula con un patrón de bandas normal y a la izquierda una célula con un patrón de bandas correspondiente a una tetrasomía de la región 12p. Fuente: Lexel SRL.
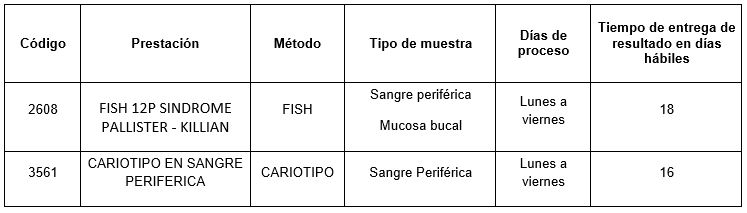
Desde el sector de Citogenética de Cibic Laboratorios, contamos con las prestaciones 2608 FISH 12P SINDROME PALLISTER – KILLIAN y 3561 CARIOTIPO EN SANGRE PERIFERICA.
Prestaciones disponibles en Cibic Laboratorios:
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1- Sebastian Sailer, Gemma Arca Díaz, Maria Hernandez García, Aurora Sánchez Díaz, José Manuel Rodriguez Miguélez, María Elena Muñoz Fernández; Síndrome de Pallister-Killian: Die Diagnose liegt im Detail; Klin Padiatr 2019; 231(02): 93-95
2- Izumi K, Krantz ID. 2014. Pallister–Killian syndrome. Am J Med Genet Part C Semin Med Genet 9999:1–8.
3- Mendelsberg-Fishbein P, García-Delgado C, Muñoz-Martínez LB, et al. Síndrome de Pallister-Killian en una paciente mestiza mexicana. Reporte de caso. Arch Argent Pediatr 2018;116(1):e135-e138.
4- Gersen SL, Keagle MB. The Principles of Clinical Cytogenetics. USA. Humana Press. 2013.
Para mayor información o consultas:
Sección: Citogenética

Bioq. Sibila Bertalot

Lic. Veronica Vanrell

Tec. Victorina Carbone
Tel: 0341-4861600. Int: 283

