Las micosis superficiales, ampliamente distribuidas en el mundo, son afecciones producidas por el parasitismo fúngico en las estructuras córneas de la piel y sus faneras (pelos y uñas). Estas micosis se clasifican en dermatofitosis (tineas o tiñas), dermatomicosis (pitiriasis versicolor, tinea negra, candidiasis superficiales y otras infecciones por levaduras) y pilodonosis (piedra blanca, piedra negra). Las de mayor incidencia en nuestro país son las dermatofitosis, las infecciones por levaduras y pitiriasis versicolor.
El diagnóstico micológico se apoya en tres puntos:
A. El cuadro clínico de paciente. Las micosis presentan un cuadro clínico más o menos definido, sin embargo, muchas veces es necesario realizar diagnóstico diferencial con otras enfermedades infecciosas o no, debido a la similitud de su sintomatología.
B. Epidemiología.
Los hongos viven asociados a seres vivos, a sus madrigueras o a los restos de materia orgánica que ellos producen. Según su hábitat, los dermatofitos, se los clasifica en: geofílicos, zoofílicos y antropofílicos.
La incidencia y aislamiento de las distintas especies de dermatofitos varía mucho de unas regiones a otras del mundo siendo influidas por múltiples factores como: edad, sexo, grupo étnico, hidratación, humedad, poder patógeno, resistencia del hospedero, fuente de infección, estado inmunológico del paciente, etc.
En el caso de las micosis superficiales es necesario conocer los siguientes datos del paciente:
• Hábitos de esparcimiento, para detectar contacto con el reservorio del agente causal.
• Medicación que recibe o recibió, tanto antifúngica como de otra naturaleza.
• Enfermedades que sufre, ya que hay algunas que están estrechamente asociadas a las micosis.
C. El examen micológico. En micología la observación directa del hongo en el material tiene valor diagnóstico por sí sola debido al carácter de patógeno primario del microorganismo: éste es el caso de los dermatofitos. Cuando desarrolla en cultivo un hongo saprófito o comensal, es necesario determinar su importancia clínica en base a las características del paciente.
El laboratorio y el diagnóstico de las micosis superficiales.
Los puntos a tener en cuenta en el análisis micológico son:
• La recolección y transporte de muestras.
• El procesamiento de las mismas.
• La identificación de cepas.
• La interpretación de resultados.
Recolección de muestras
Indicaciones previas al paciente.
Suspender la medicación antifúngica interna y/o externa, inclusive los remedios caseros, durante un lapso no inferior a los 3 días antes de efectuar la toma de muestra. De igual modo se suspende el uso de pomadas, talcos, tinturas u otras sustancias que enmascaren la presencia, inhiban o alteren la viabilidad de los hongos.
Toma de muestra en piel y cuero cabelludo:
El día de la toma de muestra higienizar lo zona con agua y jabón neutro (jabón de glicerina, jabón blanco). Si la lesión de piel sangra, colocar solamente una gasa estéril sobre la zona afectada, sosteniéndola con cinta adhesiva.
Toma de muestras en uñas:
No cortar las uñas la semana antes a la obtención del material, ni tampoco esmaltarlas (quitar el esmalte antes de las 48 h. de la toma de muestra). Cepillar las uñas con un cepillo blando, jabón neutro y agua, tres veces al día durante los tres días previos a la toma de muestra. Durante el mismo lapso, hacer diariamente baños con agua y sal en esa región (una cuchara sopera de sal fina en 1 litro de agua hervida y entibiada). Si el examen es de los pies (uñas, interdigitales, talón o plantas) concurrir al laboratorio con calzado cerrado y medias de algodón, sin restos de talco.
Preparación del sitio para la toma de muestras:
En el momento de la toma de muestra se desinfecta la zona con solución fisiológica (SF).
Métodos de obtención de muestras.
Existen tres tipos de técnicas básicas de recolección de especímenes para estudio de micosis superficiales:
A) La cinta adhesiva transparente: esta técnica consiste en cortar un fragmento de cinta adhesiva transparente de aproximadamente 10 cm de largo, que se aplica con la cara engomada sobre la lesión de piel y se presiona, raspando con el borde lateral de la uña, la superficie de la cinta que cubre la zona afectada para que se adhieran las escamas. La cinta se retira obteniéndose así la impronta de la lesión. A continuación, se aplica la cinta por los extremos sobre un portaobjetos limpio y estéril, rebatiendo los extremos hacia abajo para que no se despegue. La muestra así preparada puede ser remitida al laboratorio. Esta técnica se utiliza sólo para realizar un examen directo cuando hay sospecha de infección por Malassezia sp., causante de la pitiriasis versicolor.
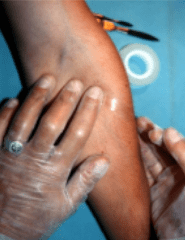
Foto: Fuente: INEI (Instituto Nacional de enfermedades infecciosas).
B) Raspado: se utiliza para todas las lesiones descamativas de la piel glabra (sin pelo). Para obtener el material se raspa el borde activo de la lesión con un bisturí estéril colocado perpendicularmente a la superficie de la piel.
Si las lesiones son vesiculosas se remueve el techo de las vesículas con el bisturí. Cuando la lesión afecta los pliegues interdigitales el material se toma del borde de las lesiones, junto a la piel sana de los dedos o de la planta del pie, evitando las áreas maceradas.
Si la lesión afecta las uñas se raspa la cara profunda de la superficie afectada, próxima a la región sana de la uña (si la hay), se recogen los residuos epidérmicos depositados entre la lámina de las uñas y el lecho subungueal (se elegirán las zonas friables, de color anormal o hiperqueratósicas).
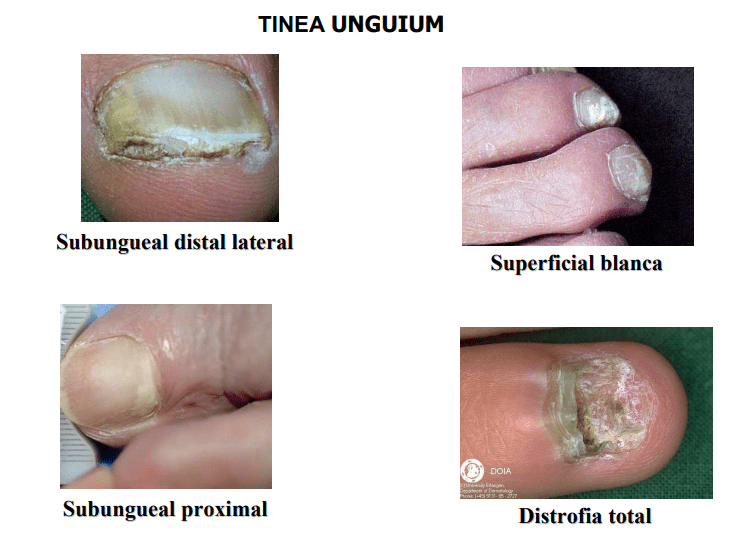
Fotos: Fuente: CEREMIC (Centro de Referencia de Micología).
C) Depilación: se utiliza en las lesiones de cuero cabelludo y otras áreas pilosas, y para recoger el vello de la piel cuando el folículo está inflamado (tinea corporis). La muestra se toma con pinza depilatoria estéril aplicada perpendicularmente a la superficie de la piel y siguiendo el sentido del pelo. Se presiona el cuero cabelludo con la pinza y se retira el pelo enfermo (deslucido, debilitado, grisáceo o los muñones cortos) y las escamocostras adyacentes. Se deben extraer además las escamas circundantes.
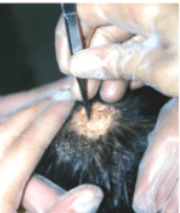
Foto: Fuente: INEI (Instituto Nacional de enfermedades infecciosas).
Transporte y conservación de muestras
Se recogerán las escamas de piel y uñas y los fragmentos de cabello entre dos portaobjetos desengrasados, limpios y estériles; se envolverán en un papel, luego se sellarán los bordes del papel y se recomienda enviar al laboratorio junto con una ficha donde se anoten los datos del paciente y las características macroscópicas de la lesión. Los envíos no necesitan refrigeración y ningún medio de transporte.
Identificación de cepas
El examen directo en fresco con KOH al 10%-40% permite observar todos los hongos capaces de producir micosis superficiales. Se pueden observar hifas tabicadas hialinas o dematiáceas, artroconidios y elementos levaduriformes.
La coloración de Azul de Metileno (AM) al 1 % es eficiente para detectar elementos característicos de Malassezia spp. (levaduras redondas u ovaladas, rodeadas de fragmentos miceliares cortos, de extremos rectos y angulares) en las escamas de piel.
Los dermatofitos se aíslan en medios con antibióticos (que inhiben el desarrollo de las bacterias que eventualmente pueden contaminar las muestras) y con cicloheximida (que inhibe el desarrollo de la mayoría de los hongos miceliales y levaduras saprófitas que pueden estar también presentes como contaminantes).
Ocasionalmente otros hongos filamentosos pueden invadir primariamente uñas y piel. Estos hongos saprófitos, pertenecientes a los géneros Aspergillus, Scopulariopsis y otros habitualmente no crecen en medios de cultivo que contienen cicloheximida.
La temperatura de incubación para el primocultivo de agentes de micosis superficiales es 25ºC – 28ºC durante un período de tres semanas. Todas las muestras deben cultivarse, háyanse visto o no estructuras fúngicas en los exámenes directos del material.
Cuando en todos los tubos se observa desarrollo de más de un hongo contaminante, exógeno o endógeno, se debe solicitar nueva muestra haciendo hincapié en respetar las condiciones preanalíticas establecidas.
En pacientes inmunocomprometidos se deben informar todos los hongos aislados aunque no se hayan visto en el examen directo. Siempre es conveniente aclarar si el aislamiento es un contaminante habitual exógeno o endógeno de este tipo de muestra, a fin de evitar el tratamiento innecesario. El informe final se envía cuando finaliza el período de incubación o inmediatamente después de concluida la identificación de las especies aisladas.
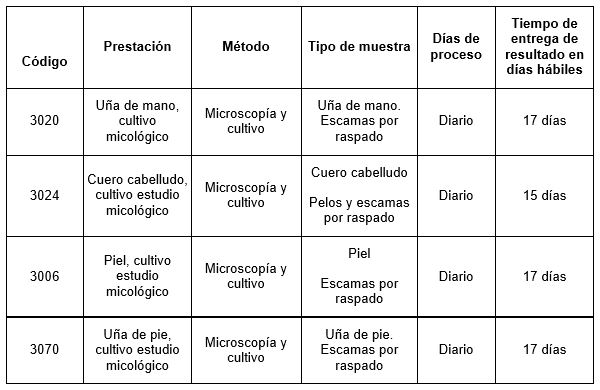
Prestaciones disponibles en Cibic Laboratorios
Referencias
– Curso a distancia y taller de diagnóstico de micosis superficiales. Departamento de Micología. Instituto Nacional de Enfermedades infecciosas “Dr. Carlos G. Malbrán” 2015.
Para mayor información o consultas:
Sección: Microbiología
Bioquímico Esteban Peyronel
Bioquímica Mary Sol Cardozo
Bioquímica Graciana Hayduk
Tel: 0341-4861600. Int: 228
