Las enfermedades cardiovasculares (ECV) conforman una de las mayores causas a nivel mundial de enfermedad y mortalidad, afectando a más de 16 millones de individuos anualmente. Tradicionalmente, el foco de atención ha sido puesto en lo que suelen denominarse factores de riesgo individuales asociados al estilo de vida (ej. dieta, tabaquismo, ejercicio) dado que las ECV se hallan frecuentemente relacionada a su vez, con otras enfermedades tales como diabetes y obesidad. Sin embargo, durante los últimos años, con el fin de diagnosticarlas en forma inequívoca, se ha prestado especial atención al estudio e identificación de factores de riesgo genéticos.
Cardiomiopatía restrictiva (CMR) – La CMR es una enfermedad del miocardio poco frecuente, cuya prevalencia es de menos de un caso cada 5.000 individuos. CMR presenta una elevada morbi/ mortalidad que se caracteriza por un llenado ventricular defectuoso en presencia de un corazón no hipertrofiado, con función sistólica normal, con ventrículos de tamaño normal o reducido y aurículas muy aumentadas de tamaño. Inicialmente se postuló su origen debido únicamente a enfermedades infiltrativas o sistémicas de herencia mendeliana (ej. Amiloidosis hereditaria), pero recientemente, también se han identificado mutaciones responsables en genes sarcoméricos (ej. Sarcoidosis) (1-3).
Es importante tener en consideración que la CMR puede coexistir con la miocardiopatía hipertrófica o dilatada en la misma familia, dado que su concepto se define desde el punto de vista funcional más que desde el punto de vista estructural (4). De esta forma, cuando las enfermedades sistémicas ya han sido descartadas, el análisis genético para descartar CMR debería formar parte esencial en el estudio de esta cardiomiopatía.
Finalmente, es fundamental para este tipo de patologías el correcto diagnóstico molecular en el menor tiempo posible, impactando esto directamente en la toma de decisiones por parte de los médicos especialistas.
Las dificultades en el diagnóstico de mutaciones asociadas a CMH por técnicas de secuenciación tradicionales (tipo Sanger), radican en la elevada demanda en tiempo de mano de obra especializada debido al elevado número de genes que deben ser analizados. En la actualidad, es posible la realización de este tipo de estudios en forma paralela (ej. sobre la misma muestra, secuenciación simultánea de todos los genes sospechados) mediante secuenciación NGS (Next generation Sequencing, por sus siglas en Inglés).
Lo anteriormente mencionado impacta en forma directa en:
(i) el tiempo que demora la obtención de un correcto diagnóstico molecular siendo crítico el tiempo efectivo en el que un resultado es entregado al especialista solicitante.
(ii) costo-efectividad de el/los análisis a realizar (ej. la secuenciación de un único gen puede llevar varias semanas de trabajo, aumentando este tiempo si más de un gen debe incluirse en el pipeline del diagnóstico molecular).
Prestación disponible en Cibic:
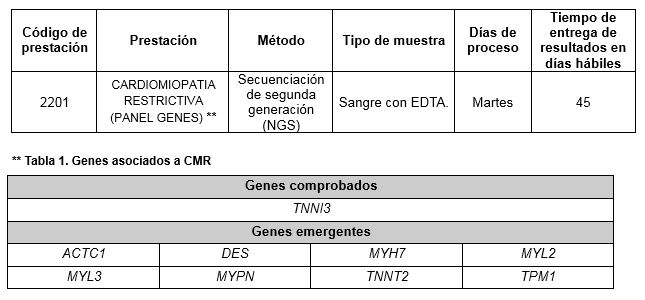
Los genes comprobados son aquellos en los cuales se han descripto mutaciones como causantes de la patología en estudio.
Los genes emergentes son genes en los cuales mutaciones asociadas a la patología en estudio han sido asociados recientemente.
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1- ACC (American College of Cardiology) https://www.acc.org/
2- AHA (American Heart Association) https://www.onlineaha.org/
3- ESC (European Society of Cardiology) http://www.escardio.org/
4- Sen-Chowdhry S y cols. Genetics of restrictive cardiomyopathy. Heart Fail Clin. 2010;6:179-86.
Para mayor información o consultas:
Sección: Biología Molecular
Dra. María Florencia Gosso.Tel.: 0341-4499444. Int: 258.

Lic. Guadalupe Méjico. Tel.: 0341-4499444. Int: 239.

Lic. Analía Seravalle.Tel.: 0341-4499444. Int: 242.