La infección por el virus de la hepatitis C (VHC) continua siendo un importante problema de salud. A nivel mundial se estima que existen 185 millones de infectados. El VHC cursa, en alrededor del 85% de los casos, como una enfermedad crónica con daño hepático progresivo que conduce hacia la cirrosis y sus complicaciones, entre ellas el hepatocarcinoma.
El entendimiento molecular del ciclo de vida viral permitió que rápidamente se desarrollen nuevos agentes antivirales de acción directa (AAD), con los cuales se obtienen tasas de cura que exceden el 90%, en la mayoría de las poblaciones. Los AAD desarrollados tienen como target proteínas involucradas en el ciclo de vida del virus, la proteasa NS3/4A, la polimerasa RNA dependiente NS5B y la proteína NS5A.
Una regla simple para identificar a que familia corresponde un AAD involucra al nombre del mismo. Los inhibidores cuyo nombre termina en -asvir, pertenecen a la familia cuyo target es NS5A, los que terminan en -previr, son los inhibidores de la proteasa NS3/4A, y los que terminan en -buvir son los inhibidores de la NS5B.
A partir de la oferta de numerosos antivirales se redactaron consensos en los cuales se recomiendan nuevos esquemas de tratamiento libres de Interferón (IFN), droga que junto a la Ribavirina conformaban la combinación Gold Standard de tratamiento de la Hepatitis C crónica durante las últimas dos décadas, que ha sido dejada de lado en la actualidad por sus efectos adversos y su baja tasa de respuesta en comparación con los AAD.
La alta tasa de replicación del VHC sumado a que la polimerasa viral (NS5B) es un tipo de enzima sin actividad correctora de errores, provoca cambios puntuales en la secuencia del genoma del virus llamados polimorfismos. Estos cambios pueden definir determinadas variantes, cambios a nivel de las proteínas virales, que causan resistencia a la mayoría de los antivirales utilizados en esquemas libres de IFN. Estas variantes son llamadas RAVs, variantes asociadas a resistencia y pueden presentarse antes del tratamiento, se las llama RAVs basales, o bien, intra o post-tratamiento llamadas simplemente RAVs.
El impacto de las RAVs depende de varios factores, entre los cuales se encuentran las características de la enfermedad del paciente (ej. cirrótico), la barrera genética y actividad de las otras drogas del esquema, y la duración de la terapia.
La optimización de los regímenes lograría superar los efectos de las RAVs. De esta manera, existen situaciones donde la detección de RAVs conduciría a la aplicación de modificaciones como el aumento de la duración de la terapia, el agregado de RBV u otros AAD, en pos de lograr una mayor efectividad.
RAVs asociados a NS3/4a
Un ejemplo claro es la mutación del aminoácido 80 de la proteasa NS3/4A, llamada Q80K, presente en un tercio de los pacientes con genotipo 1a. Se pudo observar que la presencia de esta NS3/4A RAV disminuyó considerablemente la respuesta al tratamiento en pacientes cirróticos con genotipos 1a, tratados con Simeprevir (inhibidor de NS3/4A)/ Sofosbuvir (inhibidor de NS5B). Estos datos sugieren el testeo basal de la mutación Q80K en pacientes cirróticos, con genotipo 1a, con la intención de descartar este régimen antiviral cuando el test resulte positivo.
RAVs asociados a NS5A
Otra familia donde las RAVs tienen relevancia, es la familia de los inhibidores de la proteína NS5A. Se han desarrollado numerosas drogas contra NS5A, una proteína viral involucrada en la replicación y ensamble del virión. Estas drogas son pangenotípicas, actúan independientemente del genotipo viral, motivo por el cual se encuentran en la mayoría de los esquemas recomendados como primera línea de tratamiento.
El principal problema de esta familia de drogas es la resistencia. Las RAVs en la región NS5A (NS5A RAVs) se encuentran de manera basal o en la falla al tratamiento. Estas RAVs no modifican el fitness viral (capacidad replicativa), por lo cual perduran en el tiempo condicionando el retratamiento.
Las principales NS5A RAVs identificadas son L93H y L31M. Se observó que la presencia de éstas RAVs pretratamiento reduce significativamente la respuesta a regímenes de primera y segunda generación, como Asunaprevir/ Daclatasvir o Grazoprevir/ Elbasvir. Además, pacientes que fallaron a esquemas con inhibidores de NS5A (ledipasvir, ombitasvir, dacltasvir) reducen la respuesta cuando son tratados con drogas de la misma familia. Se ha reportado que pacientes que fallaron a Sofosbuvir/Ledipasvir y fueron retratados con Sofosbuvir/Ledipasvir más Ribavirina tuvieron una tasa de cura global del 70%, 100% en pacientes sin NS5A RAVs y 60% en pacientes con NS5A RAVs. Esto evidenciaría la importancia y utilidad del test de detección de NS5A RAVs en el contexto de un retratamiento.
RAVs asociados a NS5B
La resistencia en inhibidores de la polimerasa NS5B, la tercera familia de AAD, se ha observado in vitro pero no in-vivo en pacientes naive de tratamiento. Las RAVs identificadas en la falla son la S282T y la L159F. La frecuencia de aparición de las mismas es extremadamente baja. Sólo se han presentado en pacientes con fallos susecivos a tratamientos previos, donde se cree que estos pacientes adquirieron mutaciones secundarias (variantes que pos sí solas no generan resistencia) que mejoraron el fitness viral permitiendo que el virus resista la terapia. En la actualidad, la utilidad del test de resistencia en esta familia de antivirales no sería relevante.
En todos los casos, el testeo de las variantes se realiza mediante la secuenciación de la región sobre la cual actúa el AAD, donde se obtiene una secuencia de una región del genoma viral, que resulta de la mezcla de todas las especies virales presentes en una muestra. El análisis se realiza mediante la base de datos Geno2Pheno. La base de datos emite un reporte con las variantes de resistencia presentes y la predicción de resistencia a los distintos AAD. Es necesario contar con el genotipo viral y la región a estudiar para poder realizar el test.
Como conclusión, la recomendación de testear RAVs en pacientes que serán tratados con esquemas de AAD libres de IFN está tomando fuerza. Referentes e investigadores recomiendan el testeo de la mutación Q80K en pacientes cirróticos con genotipo 1a y de la región NS5A, tanto pretratamiento como en la falla. Esta información ayudaría a elegir correctamente el esquema de AAD, logrando la mayor eficacia posible.
Prestaciones disponibles en Cibic:
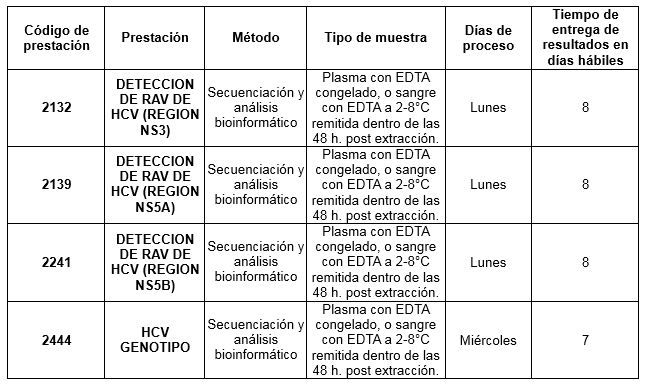
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
– Review: Shah and Fried. Treatment options of patients with chronic hepatitis c who have failed prior therapy clinical liver disease, vol 7, no 2, february 2016.
– Review: Matthias Götte and Jordan J. Feld. Direct-acting antiviral agents for hepatitis C: structural and mechanistic insights. Nat Rev Gastroenterol Hepatol., 2016 Jun;13(6):338-51. doi: 10.1038/nrgastro.2016.60
– Patrick Harrington PhD. HCV Drugs Resistance: Regulatory perspective. 2016. HIV and Hepatitis Clinical Pharmacology Workshop. Washington, DC.
http://regist2.virology-education.com/2016/17HIVHEPPK/07_Harrington.pdf.
– Ridruejo E y Galdame O, en representación de la Asociación Argentina para el Estudio de las Enfermedades del Hígado. 2016. Actualización de las recomendaciones para el tratamiento de la Hepatitis crónica por virus C. Esquemas libres de Interferón: indicaciones de tratamiento.
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Javier Alejandro Sfalcin.
Tel: 0341 4499444 Int: 241

