El gen supresor de tumores TP53 humano se encuentra localizado en el brazo corto del cromosoma 17 y codifica la proteína p53. Esta proteína, responde a diversas situaciones de stress celular para regular la expresión de genes diana, induciendo la detención del ciclo celular, la apoptosis, la senescencia, la reparación del ADN o cambios en el metabolismo (1). Se sabe que la pérdida (deleción) o interrupción de la función de p53 debido a una mutación puede conducir a la proliferación celular descontrolada y al cáncer (2).
Según se encuentra documentado, TP53 es el gen alterado con mayor frecuencia en los cánceres humanos, observándose en aproximadamente el 50% de los casos. En el dataset del Atlas del Genoma del Cáncer (TCGA), que incluye más de 10000 casos de cáncer, las mutaciones representan el 15% de los casos, las deleciones del gen (del17p) el 16% y los eventos de inactivación bialélica (una deleción y una mutación) el 22% de los casos (3).
Al relevar las mutaciones somáticas, se observa que la mayoría (~80%) son sustituciones de una sola base distribuidas a lo largo de los exones 5 a 8, los cuales corresponden al dominio de unión al DNA (4). Ocho de estas mutaciones (R175, V157F, Y220C, G245, R248, R249, R273 y R282) representan ~28 % del total de las mutaciones y se informan en múltiples tipos de tumores, lo que sugiere que hay una selección para estos alelos mutantes en el cáncer (3).
Numerosos estudios han asociado a la expresión anormal de la proteína p53, con una supervivencia deficiente del paciente. Esta asociación se demostró principalmente en los estudios relevantes en cánceres de mama, cabeza y cuello, hematopoyéticos, de hígado y de ganglios linfáticos. Sin embargo, para otros tipos de cáncer, aún no está claro si el estado de TP53 y/o sus características mutacionales podrían servir como un biomarcador potencial para establecer el pronóstico de los pacientes (5).
Las guías recomiendan el testeo del estatus de TP53 (del17p y mutaciones) en pacientes con alteraciones hematológicas como leucemia, el mieloma múltiple (MM) y síndrome mielodisplásico (SMD) para establecer pronóstico y conductas terapéuticas.
En pacientes con SMD, aproximadamente el 50 % de los pacientes con un cariotipo complejo no tienen anomalías detectables en TP53 y tienen una sobrevida global (SG) comparable a la de los pacientes con cariotipos no complejos. Por lo tanto, el estado de mutación de TP53 puede ser útil para refinar el pronóstico de estos pacientes que normalmente se los considera que tienen una enfermedad de mayor riesgo (6)
En pacientes con leucemia mieloide aguda (LMA), las mutaciones de TP53 están asociadas con riesgo desfavorable y resultados deficientes en el tratamiento quimioterapéutico. Las mutaciones TP53 son más comunes en la LMA con cariotipo complejo. Sin embargo, en la LMA relacionada con la terapia, las mutaciones de TP53 están asociadas, con mayor frecuencia, con el cariotipo monosómico y con anomalías en los cromosomas 5 y 7 (7).
En los pacientes con Leucemia linfocítica crónica/Linfoma linfocítico de células pequeñas (LLC_LLCP) la del(17p), que involucra la pérdida de TP53, se asocia con frecuencia a mutaciones en el alelo restante y se relaciona con los peores resultados, con un intervalo libre de tratamiento corto, una mediana de supervivencia corta (32 meses) y una respuesta deficiente a la quimioterapia. La del(17p) se observa con mayor frecuencia en pacientes con LLC tratada previamente, lo cual sugiere que puede ocurrir la adquisición o expansión de clones de LLC con la del(17p) durante el transcurso del tratamiento. A su vez, se ha visto que en pacientes menores de 65 años sin del(17p) ni mutación de TP53, presentan buena respuesta a terapias específicas (8).
Por su lado, en los pacientes con MM, la del17p conduce a la pérdida de heterocigosidad del TP53 la cual se considera una característica de alto riesgo para esta patología (9).
Dado que las alteraciones en TP53 ocurren en ~50% de los cánceres humanos y rara vez ocurren en tejidos normales, estas pueden considerarse objetivos terapéuticos específicos e ideales para el tratamiento del cáncer. En los últimos años se han estado desarrollando terapias dirigidas a alteraciones en TP53 que emplean diferentes enfoques como: (a) restauración o estabilización de la conformación de p53 salvaje (p53wt) a partir de p53 mutada (p53mut), (b) rescate de mutaciones sin sentido de p53, (c) agotamiento o degradación de proteínas p53mut y (d) inducción de letalidad sintética de p53 o selección de vulnerabilidades impuestas por mutaciones/deleciones en p53 (10). Por lo cual es de esperar que, en un futuro, evaluar el estado mutacional y el tipo de mutación de TP53 sea requisito sine qua non para poder acceder a este tipo de terapéuticas.
En Cibic Laboratorios, contamos con las siguientes determinaciones para evaluar el estatus somático del gen TP53:
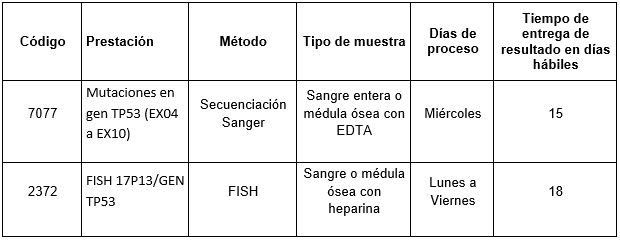
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias
1 – Liu J, Zhang C, Feng Z. Tumor suppressor p53 and its gain-of-function mutants in cancer. Acta Biochim Biophys Sin (Shanghai). 2014;46:170–179.
2 – George P. p53 how crucial is its role in cancer. Int J Curr Pharm Res. 2011;3:19–25.
3 – Flynt E, Bisht K, Sridharan V, Ortiz M, Towfic F, Thakurta A. Prognosis, Biology, and Targeting of TP53 Dysregulation in Multiple Myeloma. Cells. 2020 Jan 24;9(2):287. doi: 10.3390/cells9020287. PMID: 31991614; PMCID: PMC7072230..
4 – Olivier M, Hollstein M, Hainaut P. TP53 mutations in human cancers: origins, consequences, and clinical use. Cold Spring Harb Perspect Biol. 2010;2:a001008.
5 – Zhang W, Edwards A, Flemington EK, Zhang K. Significant Prognostic Features and Patterns of Somatic TP53 Mutations in Human Cancers. Cancer Inform. 2017 Feb 20;16:1176935117691267. doi: 10.1177/1176935117691267. PMID: 28469388; PMCID: PMC5392013.
6 – https://www.nccn.org/professionals/physician_gls/pdf/mds-spanish.pdf
7 – https://www.nccn.org/professionals/physician_gls/pdf/aml-spanish.pdf
8 – https://www.nccn.org/professionals/physician_gls/pdf/cll-spanish.pdf
9 – https://www.nccn.org/professionals/physician_gls/pdf/myeloma-spanish-latin-america.pdf
10 – Nishikawa S, Iwakuma T. Drugs Targeting p53 Mutations with FDA Approval and in Clinical Trials. Cancers (Basel). 2023 Jan 9;15(2):429. doi: 10.3390/cancers15020429. PMID: 36672377; PMCID: PMC9856662
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Alan Gomez.
Tel +54 (341) 4861600 (Int. 225)
Lic. Analía Seravalle.
Tel +54 (341) 4861600 (Int 242)
Sección: Análisis Especiales
Lic. Mariano M. Gonzalez, PhD
Tel. +54 (341) 4861600 (int. 227)
Bioq. Sibila Bertalot
Tel. +54 (341) 4861600 (int. 283)

