La leucemia linfocítica crónica (LLC) es la leucemia más frecuente en adultos, que comprende hasta el 30% de todas las leucemias. Ocurre en pacientes de mediana edad hasta ancianos con un predominio masculino, y no en niños (1).
Es una neoplasia compuesta por linfocitos B pequeños, redondos, ligeramente irregulares en la sangre periférica, médula ósea, bazo y ganglios linfáticos, asociados con prolinfocitos y parainmunoblastos que forman centros de proliferación en tejidos infiltrados (2).
Los pacientes con LLC pueden presentar una amplia gama de síntomas y signos al momento del diagnóstico, sin embargo un 70% de ellos son diagnosticados en forma incidental durante un recuento hematológico de rutina.
Las manifestaciones clínicas incluyen:
– Linfadenopatías pequeñas y simétricas cervicales (50-90% de los casos), supraclaviculares y/o axilares.
– Esplenomegalia, moderada, no dolorosa (25-54% de los casos).
– Hepatomegalia, moderada, no dolorosa (10-20% de los casos).
– Inmunodeficiencia adquirida: hipogammaglobulinemia.
– Predisposición a infecciones repetidas, como neumonía, herpes simple labial y herpes zóster.
– Astenia y fatiga.
– Fiebre, escalofríos, sudores nocturnos y pérdida de peso (síntomas B).
– Anemia hemolítica y/o trombocitopenia autoinmunes (2).
La LLC se caracteriza por un curso clínico extremadamente variable. Menos del 30% de los pacientes tienen un curso indolente y eventualmente mueren por causas no relacionadas a la enfermedad, mientras que el 15% muere rápidamente (dentro de dos a tres años desde el diagnóstico) por LLC y / o causas relacionadas con el tratamiento. En los pacientes restantes, la enfermedad tiene un curso relativamente indolente durante los primeros 5 a 10 años, seguido de una fase terminal marcada por una considerable morbilidad, tanto por la enfermedad misma como por complicaciones de la terapia (3).
En el momento del diagnóstico la mayoría (2/3) de los pacientes con LLC no necesitan tratamiento. Lo requerirán ante la presencia de síntomas y/o la evidencia de progresión. Los pacientes de bajo riesgo sólo requieren un seguimiento cada 3 meses el primer año y luego bianual. En múltiples estudios el inicio temprano de la quimioterapia no ha demostrado beneficio, y podría aumentar la morbilidad en la LLC.
El tratamiento de la LLC originalmente estuvo sólo dirigido a paliar los síntomas. El uso de regímenes combinados con mayor capacidad de erradicar células leucémicas, ha logrado que más del 50% de los pacientes alcancen remisión y que tengan una supervivencia libre de tratamiento >5 años. El objetivo actual de tratamiento es alcanzar respuesta clínica completa. Los pacientes con enfermedad mínima residual negativa presentan remisiones más prolongadas y una mayor tasa de supervivencia, sin embargo no está recomendado intensificar el tratamiento con el objetivo de alcanzar la EMR negativa (2).
Dado que el curso de la LLC es muy heterogéneo, las respuestas a la terapia varían y las opciones terapéuticas aumentan, la estratificación precisa del riesgo para predecir el pronóstico y las respuestas al tratamiento son altamente pertinentes. Los factores pronósticos adversos incluyen el gen de la inmunoglobulina VH (IgVH) no mutada y la expresión de los marcadores CD38 y ZAP-70. A pesar de su valor pronóstico, estas variables tienen un valor limitado en el tratamiento (4).
Hasta ahora, las aberraciones citogenéticas de los reguladores fundamentales de la ruta de respuesta al daño del ADN (DDR), es decir, TP53 y, en menor medida, ATM, se ha demostrado que proporcionan la información predictiva más poderosa sobre el resultado clínico y sobre la capacidad de respuesta tanto a la quimioterapia como a las nuevas opciones de tratamiento dirigido. De hecho, en la actualidad, los únicos marcadores que influyen en las decisiones de tratamiento son las mutaciones y / o deleciones de TP53 (deleción del 17p) y, en cierta medida, deleciones en ATM (deleción del 11q) (5). Los pacientes no mutados y/o con deleción 17p deben seguirse con mayor frecuencia ya que presentan alto riesgo de progresión.
La hibridación de sondas fluorescentes con ADN celular mediante la técnica de FISH (Fluorescence in situ hibridization) permite el estudio de aberraciones genéticas que son demasiado pequeñas para visualizar por estudios citogenéticos de rutina (cariotipos) y demasiado grandes para detectar utilizando secuenciación estándar. En Laboratorios Cibic disponemos de las prestaciones 2371: FISH del(11Q22) GEN ATM y 2372: FISH del(17P13) GEN TP53 que proporcionarán información de relevancia acerca de la presencia o ausencia de cada gen.
Prestaciones disponibles en Cibic:
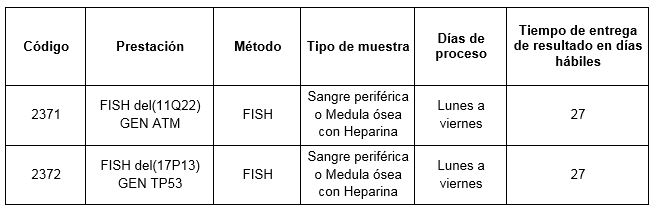
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Referencias:
1. Marilyn S. Arsham, Margaret J. Barch, Helen J. Lawce. (Cuarta edición- 2017). The AGT Cytogenetics Laboratory Manual
2. Sociedad Argentina de Hematología (2019).Guía de Diagnóstico y Tratamiento
3. Byrd JC, Stilgenbauer S, and Flinn IW. Chronic lymphocytic leukemia. Hematology. Am.Soc.Hematol.Educ.Program. 163-183. 2004.
4. Raa GD, Kater AP, TP53 Dysfunction in CLL: Implications for Prognosis and Treatment, Best Practice & Research Clinical Haematology (2016).
5. Rosenquist R, Cortese D, Bhoi S, Mansouri L, Gunnarsson R. Prognostic markers and their clinical applicability in chronic lymphocytic leukemia: where do we stand? Leuk.Lymphoma 2013;54:2351-2364.
Para mayor información o consultas:
Sección: Citogenetica
 Bioq. Sibila Bertalot
Bioq. Sibila Bertalot
 Téc. Verónica Vanrell
Téc. Verónica Vanrell
Tel: 0341-472 2424. Int: 283
