Importante avance del Instituto de Biología Molecular y Celular de Rosario; es una novedad mundial.
Fuente: Diario La Nación | suplemento Ciencia | Nora Bär | 19/07/2016
En 2008, un paciente sueco que había viajado a la India a hacerse una cirugía estética contrajo una bacteria resistente a todos los antibióticos. Al volver, murió. Después de estudiar el caso, el equipo del investigador australiano Tim Walsh descubrió que la clave de la resistencia de esa “superbacteria”, una Klebsiella pneumoniae, estaba en una enzima (una proteína que regula reacciones químicas en los seres vivos), que llamaron NDM-1 (por New Delhi Metallo 1).
Lo que pasó a continuación pondría en pie de alerta a los sistemas sanitarios del mundo. La enzima que volvía resistentes a las bacterias contra los antibióticos que son utilizados como último recurso empezó a propagarse por todo el planeta a una rapidez y con una frecuencia “nunca antes vista”, dijo Walsh. Hoy, está presente en más de 80 países, incluida la Argentina, y en toda una lista de bacterias oportunistas.
“Las enzimas son codificadas por genes, pero si uno miraba los mecanismos tradicionales por los cuales se transfieren genes entre bacterias, no alcanzaba para explicar esta diseminación inusitada”, explica Alejandro Vila, investigador superior del Conicet y director del Instituto de Biología Molecular y Celular de Rosario (IBR).
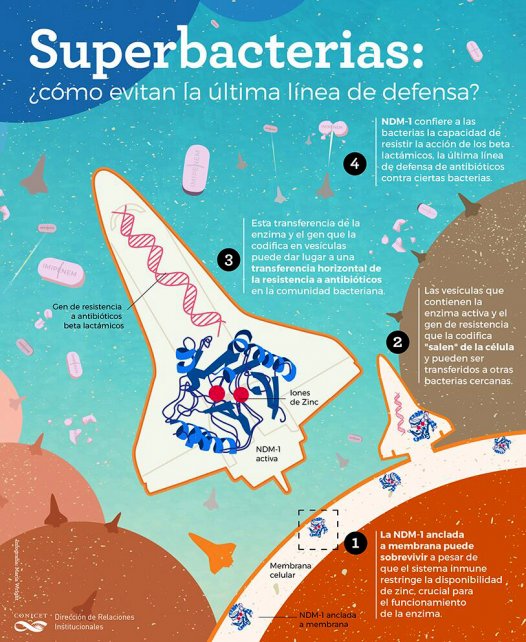
Ahora, su grupo, en colaboración con científicos norteamericanos, acaba de encontrar la respuesta a este enigma: la enzima que convierte a las bacterias en una especie de Terminator de Lilliput, en lugar de estar soluble en el espacio periplasmático [es decir, que rodea al citoplasma, que es, a su vez, la parte de la célula que rodea al núcleo], como las otras de su tipo, se ancla a la membrana externa de la bacteria.
“Esto le confiere dos ventajas principales –explica Vila, desde Rosario–. Por un lado, estas enzimas NDM-1 usan un metal, el zinc, para ser activas. Cuando hay un proceso de infección, el sistema inmune saca todos los metales del medio «para matar de hambre» a las bacterias, pero las que tienen NDM-1 anclada a la membrana, cuando hay condiciones de falta de zinc, pueden resistir. Además, hay algo todavía peor: las células bacterianas pueden «dispararlas» al exterior dentro de unas «bolitas de grasa» y así crece la resistencia a los antibióticos en comunidades bacterianas.”
“Cuando una vesícula que transporta la enzima activa llega a bacterias que son sensibles a estos antibióticos, la NDM-1 se les une y es como si estas bacterias también la expresaran y se vuelven resistentes, al menos transitoriamente”, detalla Lisandro González, becario posdoctoral del IBR y primer autor de la investigación, en el comunicado del Conicet.
Fuente: conicet
Una caja de Pandora
El trabajo de acaba de publicarse en Nature Chemical Biology y el mes pasado fue seleccionado entre los Top Ten del año en el congreso de la Sociedad Norteamericana de Microbiología. Allí, Tim Walsh, descubridor de la NDM-1, le dijo a Vila: “¡Abrieron la caja de Pandora!”.
Estos hallazgos no sólo iluminan un mecanismo completamente desconocido de resistencia bacteriana y de transmisión horizontal de la resistencia, sino que dieron lugar a una mejora en los tests de detección de NDM-1.
“Sabíamos que fallaban hasta en un 50% [daban resultados negativos aunque la enzima estuviera presente en la muestra] y no había explicación lógica, porque con otras metalo-beta-lactamasas no pasaba cuenta Alejandra Corso, jefa del servicio de antimicrobianos de la Administración Nacional de Laboratorios e Institutos de Salud “Doctor Carlos G. Malbrán” (Anlis)-. Con Alejandro nos encontramos en un congreso, en los Estados Unidos, nos contó los resultados de su investigación y en un instante se nos iluminó la respuesta: claro, no la podemos detectar porque queda anclada. A partir de ahí decidimos trabajar en conjunto y vimos que con un detergente podíamos liberar la enzima para detectarla. Lo probamos y ahora, hacer esta detección sale un peso.
Todos los laboratorios del país están usando este método para las beta-lactamasas en general, incluyendo la NDM-1. Es una muestra de la aplicabilidad clínica de un trabajo de ciencia básica en tiempo récord. Pasa muy pocas veces en la vida.”
Para Corso, el avance de los investigadores del IBR es “importantísimo”. “Es un mecanismo totalmente novedoso, que no se había descripto en el mundo. Que las enzimas se liberen en vesículas y se fusionen con la membrana de otras bacterias… Y encima poder usar ese conocimiento para encontrar una prueba de detección a muy bajo costo… ¡Es fantástico!”
Según datos del Anlis, de cada 10.000 personas que ingresan a un hospital en la Argentina, una es portadora de la enzima NDM-1.
Fernando Pasterán, investigador principal del Servicio de Antimicrobianos del Anlis-Malbrán, destaca que los pacientes infectados con bacterias resistentes a los antibióticos tienen entre un 20 y 70 por ciento más de riesgo de morir que cuando están infectados por el mismo germen, pero sin la multirresistencia. “Si no podemos frenar este fenómeno, en un futuro inmediato no se podrán realizar muchos procedimientos diagnósticos o terapéuticos que hasta ahora son de rutina”, concluye Pasterán.
