La enzima convertidora de angiotensina (ACE por sus siglas en inglés, OMIM:10618) cumple un rol esencial en el sistema renina-angiotensina-aldosterona (SRAA). ACE convierte angiotensina I (AI) en angiotensina II (AII), el péptido activo más potente para SRAA, tanto a nivel circulatorio como a nivel tisular cuyo efecto principal es el de llevar de forma directa o indirecta a la elevación de la presión arterial sanguínea así como a una retención incrementada de sodio y de agua en el organismo. ACE también cataboliza la degradación de bradiquinina, un potente vasodilatador del sistema hormonal calicreína- cininas.

El nivel de concentración de ACE se encuentra regulado genéticamente, siendo el polimorfismo indel (ID ACE; dbSNP rs 4646994) localizado en el intrón 16 del gen, el responsable de las diferentes concentraciones de la enzima (1). El polimorfismo descripto en el gen ACE da como resultado tres genotipos posibles: DD, II y ID.
Existe correlación entre el genotipo y el nivel de actividad de ACE: individuos homocigotas para el alelo D (genotipo DD) poseen aproximadamente el doble de enzima comparado con individuos homocigotas para el alelo I (genotipo II), mientras que individuos heterocigotas ID, presentan niveles intermedios de la enzima, indicando codominancia (1).
Agentes inhibidores de ACE bloquean en forma competitiva la conversión de AI en AII, resultando en una disminución de AII circulante, conjuntamente con una disminución de sus efectos asociados (vasoconstricción arteriolar, retención de agua y sales). Por otro lado los inhibidores de ACE también disminuyen la metabolización de bradiquinina en péptidos inactivos, generando una mayor liberación de óxido nítrico y prostaglandinas con efecto vasodilatador.
Es de suma importancia la evaluación del estado de actividad de ACE para aquellos pacientes hipertensos refractarios al tratamiento (entre 10-30% de pacientes). Numerosos estudios indican al genotipo DD como factor de riesgo asociado al desarrollo de diversos procesos cardiovasculares (enfermedad coronaria isquémica, hipertrofia ventricular, hipertensión) (2) y complicaciones renales asociadas a diabetes mellitus (ej. nefropatía diabética) (3).
Prestación disponible en CIBIC.
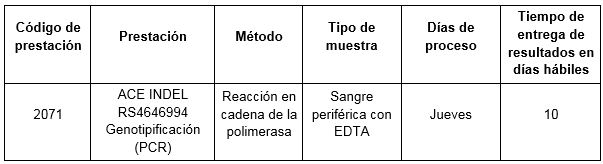
Para conocer las condiciones del paciente, de almacenamiento y de envío de la muestra y otros datos sobre las prácticas consulte al manual de prestaciones y a la extranet.
Bibliografía
1. Costerousse O y cols. Angiotensin I-converting enzyme in human circulating mononuclear cells: genetic polymorphism of expression in T-lymphocytes. Biochem J. 1993; 290:33-40.
2. Cambien F y cols. Deletion polymorphism in the gene for angiotensin-converting enzyme is a potent risk factor for myocardial infarction. Nature 1992; 359: 641–644.
3. Martinez Vea A. Polimorfismos del sistema renina-angiotensina e insuficiencia renal. Nefrologia. 2002; 22:89-94.
Para mayor información o consultas:
Sección: Biología Molecular
Lic. Guadalupe Méjico. Tel: 0341 4499444 Int: 243
Dra. María Florencia Gosso. Tel: 0341 4499444 Int: 258

