El complejo mayor de histocompatibilidad (CMH) en el humano está conformado por un grupo de genes localizados en el brazo corto del cromosoma 6. Codifica para un grupo de moléculas denominadas Antígenos Leucocitarios Humanos (abreviados HLA, acrónimo en inglés Human Leukocyte Antigen) dentro de las cuales se encuentran las de clase I (HLA A, B y C) y clase II (HLA DR, DQ y DP).
Las móleculas del CMH clase I son heterodímeros formados por una cadena polipeptídica polimórfica con 3 dominios, α1, α2 y α3 (cadena pesada) unida de manera no covalente a una cadena liviana no polimórfica llamada β2 microglobulina (no codificada en el CMH). Estas moléculas se encuentran expresadas en la membrana de la mayoría de las células nucleadas y su función es presentar péptidos a los linfocitos T CD8+ (imagen 1).
Las moléculas de CMH clase II están formadas por dos cadenas polipeptídicas unidas de forma no covalente: la cadena α con dominios α1 y α2 y la cadena β con dominios β1 y β2 que, a diferencia de las de clase I, ambas están codificadas por los genes polimórficos del CMH. Estas moléculas se encuentran expresadas en la membrana de las células presentadoras de antígenos profesionales como los linfocitos B, macrófagos, células dendríticas y su función es presentar péptidos a los linfocitos T CD4+ (imagen 2).
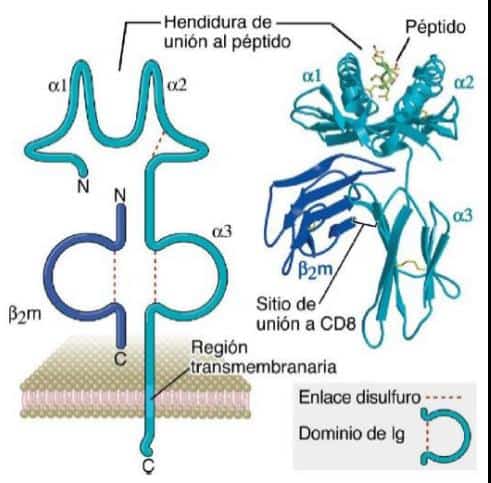
Imagen 1. Esquema y estructura 3D de la molécula CMH clase I. (Fuente: Abbas, Lichtman, and Pillai, 2012).
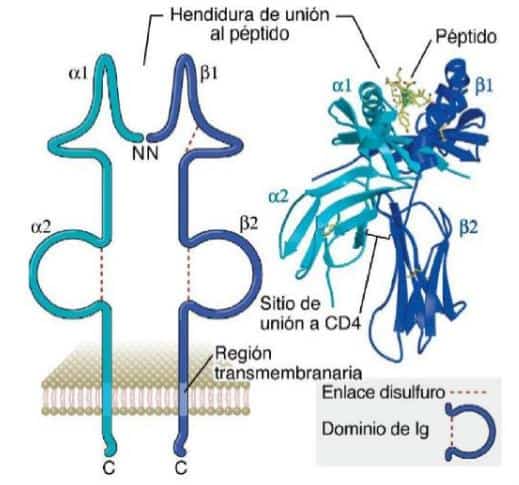
Imagen 2. Esquema y estructura 3D de la molécula CMH clase II. (Fuente: Abbas, Lichtman, and Pillai, 2012).
Conforman el complejo genético más polimórfico que existe y su herencia es codominante. Su función principal es permitir que el sistema inmune diferencie lo propio de lo extraño y participa también en la comunicación entre células.
El CMH está involucrado en la generación de la tolerancia central durante la ontogenia T, por lo tanto, si algún desperfecto llegara a ocurrir en esta etapa, se liberarían células con una inadecuada tolerancia a lo propio, es decir, autorreactivas. Así, desde hace varias décadas se sabe que el padecimiento de ciertas enfermedades se asocia con el incremento en la frecuencia de un determinado alelo HLA.
Esta asociación, cuando tiene un valor estadísticamente significativo, se considera como un factor de susceptibilidad o un marcador de riesgo a padecer una determinada enfermedad. Esto puede cifrarse estadísticamente como “riesgo relativo” (RR) y da una idea de la mayor o menor probabilidad que tiene un sujeto a padecer una determinada enfermedad si presenta dicho marcador o alelo HLA con respecto a aquellos individuos que no lo tienen. Desde un punto de vista diagnóstico, mientras más alto es el RR, más útil puede ser la tipificación de las moléculas HLA para establecer el diagnóstico.
Las enfermedades se asocian a antígenos, alelos, epitopes o haplotipos de diferentes loci dentro de la región de genes HLA y dentro de ellas se incluyen ciertas susceptibilidades a agentes infecciosos, un gran número de trastornos mediados por el sistema inmunológico como las enfermedades autoinmunes (tabla 1) y otras situaciones clínicas como la respuesta farmacológica en determinadas enfermedades (tabla 2). Sin embargo, en ninguna de estas, la asociación estadística es absoluta, lo cual es indicador de que otros genes, así como factores ambientales, desempeñan su papel en el mecanismo fisiopatogénico de las mismas.
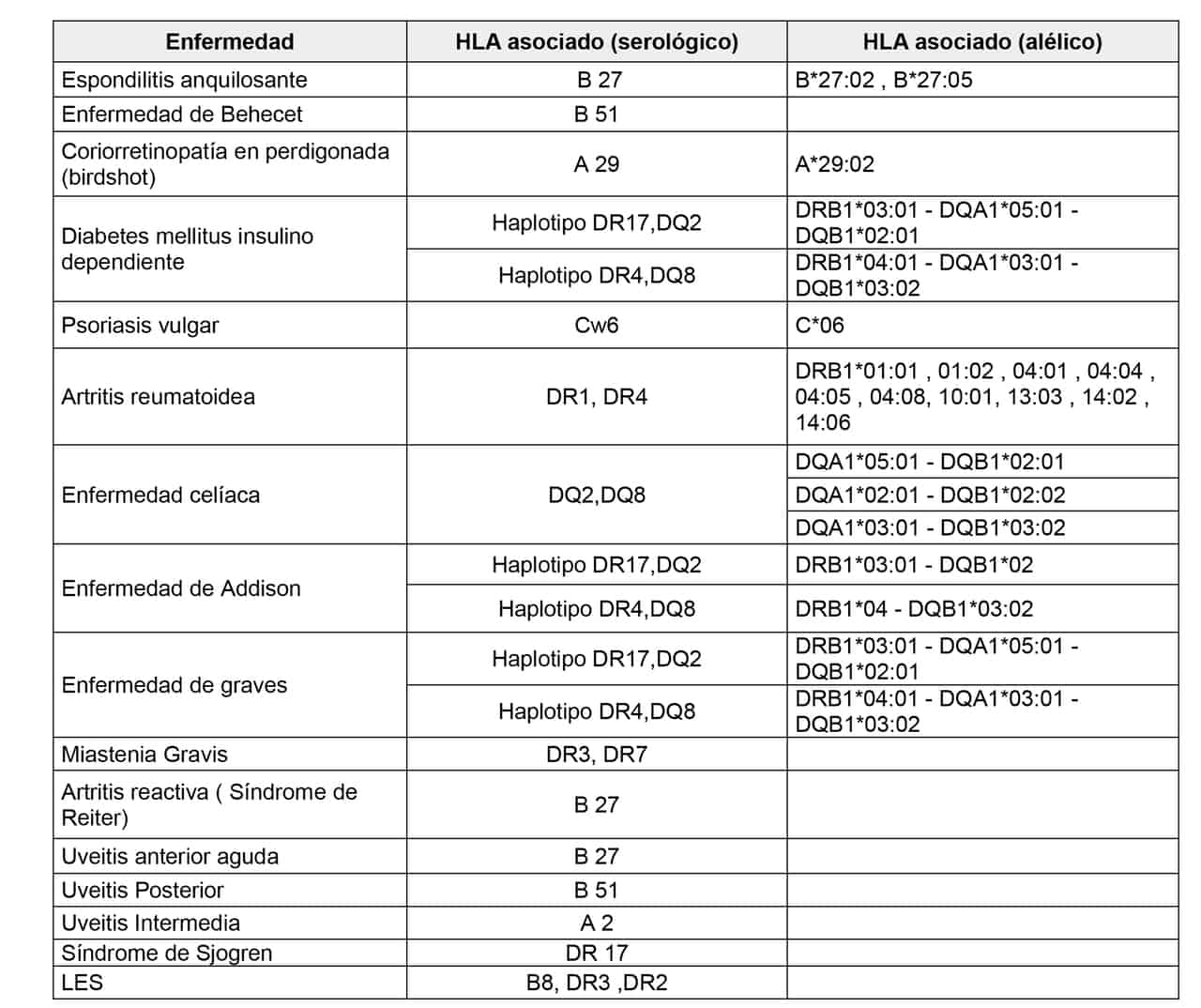
Tabla 1. Ejemplos de asociaciones HLA-Enfermedades autoinmunes.
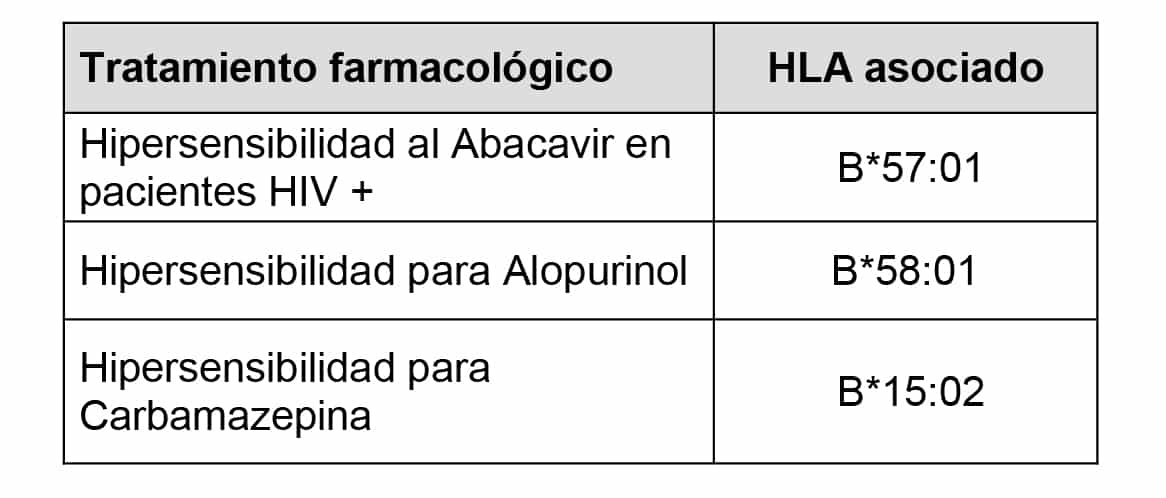
Tabla 2. Ejemplos de asociaciones HLA-Respuesta a tratamiento farmacológico.
Además de permitir la evaluación de la asociación HLA-enfermedad, la tipificación de las moléculas de HLA es de vital importancia en la medicina de los trasplantes (esté último tema, lo trataremos con mayor profundidad en un próximo artículo).
La amplificación de fragmentos de ADN mediante el uso de la Reacción en Cadena de la Polimerasa (PCR) añadió sensibilidad al genotipaje HLA. Los métodos más difundidos que utilizan la PCR incluyen la amplificación de ADN con primers de secuencia específica (PCR-SSP) y la amplificación de ADN seguida de la hibridización con sondas de oligonucleótidos de secuencia específica (PCR-SSO).
Cibic Laboratorios ha implementado el método de tipificación mediante PCR-SSO (imagen 3) que se basa en una primera instancia en la amplificación mediante PCR, de exones específicos para los loci en estudio con primers biotinilados. Luego, para discriminar entre los diferentes alelos, se utilizan sondas de oligonucleótidos específicas de secuencia (SSO) unidas a microesferas conformadas por fluorocromos, que se unen al ADN previamente amplificado para identificar los alelos correspondientes, los cuales son revelados mediante ficoeritrina unida a estreptavidina (SAPE).
Un analizador de flujo, Bio-Plex 200® – BIORAD, identifica la intensidad fluorescente SAPE en cada microesfera. Luego se utiliza un software para asignar reacciones positivas o negativas en función de la intensidad de la señal fluorescente. La asignación de la tipificación de HLA se basa en reacciones de sondas positivas y negativas en comparación con las secuencias del gen HLA publicadas.
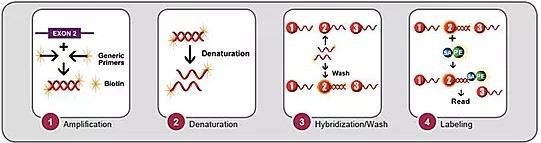
Imagen 3. Procedimiento PCR-SSO.
Es una técnica rápida, que permite analizar 96 muestras en simultáneo y con un nivel de resolución intermedio, permite asignar el grupo alélico y los subtipos posibles están englobados bajo el código NMDP (National Marrow Donor Program).
El área de Biología Molecular de Cibic Laboratorios cuenta con un analizador de flujo Bio-Plex 200® – BIORAD que utiliza la tecnología Luminex (imagen 4), la cual posibilitó la implementación de la metodología PCR-SSO para la genotipificación de los genes HLA. Esta metodología permite reducir los tiempos de proceso y de análisis, reflejándose en una mejora en los tiempos de entrega de resultados.

Imagen 4. Instrumento Bio-Plex® 200-BIORAD
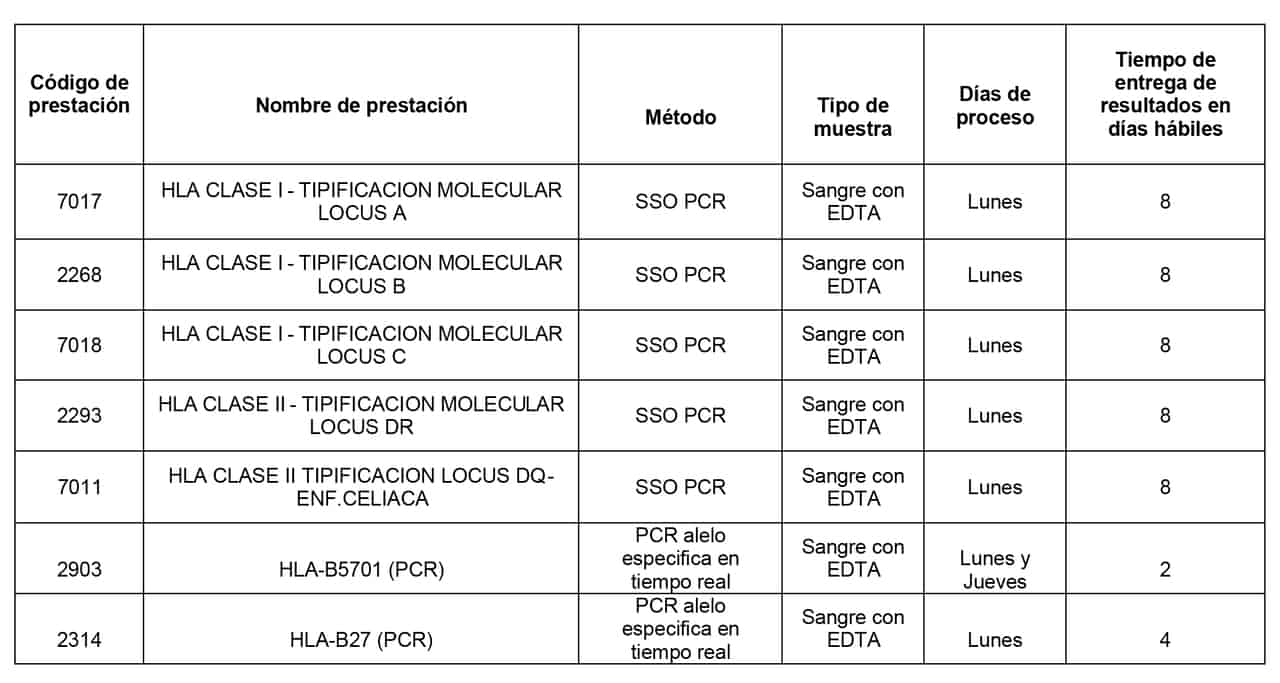
Prestaciones disponibles en CIBIC Laboratorios:
Referencias
1- Kathleen Madden & Devon Chabot-Richards.HLA testing in the molecular diagnostic laboratory. Springer-Verlag GmbH Germany, part of Springer Nature 2018.
2- Delordson Kallon.Histocompatibility & Immunogenetics, A collection of brief revision notes, clinical application, chapter 6 Disease Associations, pág 57 – 74, 2011.
3-Leccese, P., & Alpsoy, E. (2019).Behçet’s Disease: An Overview of Etiopathogenesis. Frontiers in Immunology, 10.
4-Chen, L., & Tsai, T.-F. (2018). HLA-Cw6 and psoriasis. British Journal of Dermatology, 178(4), 854–862.
Artículos relacionados previamente publicados por Cibic Laboratorios:
1-Tipificación de HLA-DQ asociado a Enfermedad Celíaca: cambio metodológico y mejora en tiempo de entrega de resultados
2-Detección de HLA-B*27 por Biología Molecular (PCR)
https://www.cibic.com.ar/home/38777/
3-Hipersensibilidad al Abacavir:análisis de la presencia del alelo HLA B*5701 en pacientes infectados con HIV.
Para mayor información o consultas:
Sección: Biología Molecular
Bioq. Sofía Favot
Tel 0341-486-1600.Interno: 242

